Снижение эффективности вакцинации цыплят-бройлеров против инфекционного бронхита кур на фоне роста инцидентности везикулярного энтерита
Инфекционный бронхит кур - широко распространенное заболевание, на территории РФ, вызываемое РНКовым вирусом, относящимся к семейству Coronaviridae. У цыплят-бройлеров этот вирус вызывает бронхиты, пневмонии и трахеиты, поражение паренхиматозных органов и провоцирует массовое развитие вторичных бактериальных инфекций (преимущественно коли-бактериоз) [5, 7, 8, 10]. В качестве одного из основных факторов, влияющих на качество вакцинации против ИБК и НБ, мы считаем везикулярный энтерит – инфекцию неизвестной этиологии, вызываемую фильтрующимися/вирусным агентом [12]. По нашим наблюдениям, рост инцидентности везикулярного энтерита, нередко сопровождается повявлением как расслоения стада по массе, так и расслоением поголовья по наличию поствакцинального иммунитета [11, 13].
Цель исследования: оценить эффективность вакцинации, цыплят-бройлеров, против ИБК на фоне мальадсорбции ассоциирующейся с везикулярным энтеритом.
к.б.н. Афонюшкин В.Н. 1,2 , Черепушкина В.С. 1 , Миронова Т.Е. 1,3 , Бобикова А.С. 1,3 , к.в.н. Волков Д.В. 1 , Хоменко Ю.С. 1 , Афонюшкин А.В. 3 , чл. корр. РАН Донченко Н.А. 1,3 , Сигарева Н.А. 3 , Балыбина Н.. 1
- Сибирский федеральный научный центра агробиотехнологий РАН, п.Краснообск, Россия
- Институт химической биологии и фундаментальной медицины СО РАН, г.Новосибирск, Россия
- ФГБОУ ВО «Новосибирский государственный аграрный университет», г. Новосибирск, Россия
Материалы и методы
Для исследований использовали образцы биоматериала и сыворотки крови от цыплят-бройлеров кросса Ross 308 одной из птицефабрик РФ, характеризующейся снижением эффективности вакцинации против инфекционного бронхита кур. Вакцинация против инфекционного бронхита кур проводилась с использованием одной из живых вакцин в 12 суточном возрасте, методом выпаивания.
Клинически здоровых цыплят, в возрасте 10 и 15 суток, подвергали диагностическому убою, оценивали наличие патологоанатомических изменений характерных для везикулярного энтерита и инфекционного бронхита. Отбирали пробы кишечника, легких и тимуса для выделения РНК, гистологических исследований.
Качество вакцинации против инфекционного бронхита кур оценивали методом ИФА, с использованием ИФА-наборов PROFLOCK (Zoetis). Исследовали сыворотку крови цыплят-бройлеров предубойного возраста.
Наличие вирусной РНК вируса инфекционного бронхита кур, до и после вакцинации, оценивали методом ОТ-ПЦР [14]. РНК выделяли на силика-колонках с предварительным разрушением клеток гуанидин-изотиоционатом. Синтез кДНК проводили с использованием олигонуклеотидного праймера 5`-tcaaactgcggatcatcacgt -3` и набора для ревертирования ООО «Биолабмикс». Присутствие в образцах геномной РНК вируса ИБК выявляли с помощью ПЦР в режиме реального времени. ПЦР проводили в конечном объеме 20 мкл, содержащем 67 мМ трис.-HCl (рН 8,9), 16 мМ (NH4)2SO4; 2,4 мМ MgCl2; 0,01% Твин 20; 0,2 mM дНТФ; 0,3 mкM растворы олигонуклеотидных праймеров 5`-atgctcaaccttgtccctagca-3` 5`tcaaactgcggatcatcacgt-3`, и зонда FAM-tggaagtagagtgacgcccaaac-BHQ, 1-2 ед. Fa-mod Taq-ДНК полимеразы. ПЦР проводили на амплификаторе CFX (BiоRad) по следующей программе: начальная денатурация - 95°С 15 мин., далее 40 циклов: денатурация - 95°С 10 сек, отжиг - 60°C 30 секунд.
Контроль выделяемости РНК из образцов проводили с использованием ПЦР в режиме реального времени специфичного в отношении мРНК гена домашнего хозяйства glyceraldehyde-3-phosphate dehydrogenase (GAPDH) по протоколу указанному выше, с использованием праймеров 5`cgtgaccccagcaacatcaa3` и 5` acttaccccagccttctccat3` taqman зонда ROX- tggagtccactggtgtcttcacc- BHQ2. Ревертирование осуществляли с использованием праймера 5` acttaccccagccttctccat3`.
Диагностику везикулярного энтерита проводили гистологически. Кусочки органов фиксировали в 10% забуференном формалин. Парафиновые срезы окрашивали гематоксилином и эозином по Вейгерту. Гистологически и патологоантомически исключали наличия других факторов повреждения слизистой кишечника (эймериозов, астровирусной инфекции, флавивирусной инфекции, гепатоспленомегалии и др.).
Для выявления наличия мальадсорбции, в качестве критерия вирусной интерференции с вакцинным штаммом, проводили биохимический мониторинг. Для этой цели отбирали пробы крови, по 25 проб, у клиничсеки-здоровых цыплят – бройлеров в возрасте 1, 6, 10, 12, 15, 21, 22, 30 дней. В качестве маркеров мальадсорбции в сыворотке крови определяли уровень цинка и магния [16, 17]. В качестве маркера лихорадочных состояний оценивали уровень хлоридов [17].
Оценку состояния кишечных ворсин проводили, по оригинальной методике [11, 15], методом люминесцентной микроскопии кусочков слизистой тощей кишки (фиксированных формалином), ткани окрашивали флуоресцентным красителем специфичным для белка (SYPRO Ruby, BioRad), ядра клеток окрашивали интеркалирующим ДНК красителем SYBRGeen I, в течение 20 минут.
Результаты собственных исследований
Как следует из результатов исследований методом ИФА, у цыплят-бройлеров в овзрасте 35 суток, наблюдалось аномально большое количество недопривитых цыплят (более 50%) в сочетании с появлением единичных проб с уровнем антител, превышающих поствакцинальный (рисунок 1). Коэффциент вариации составил 166,26%, средний арифемтический титр был 837, максимальный титр был 12658.
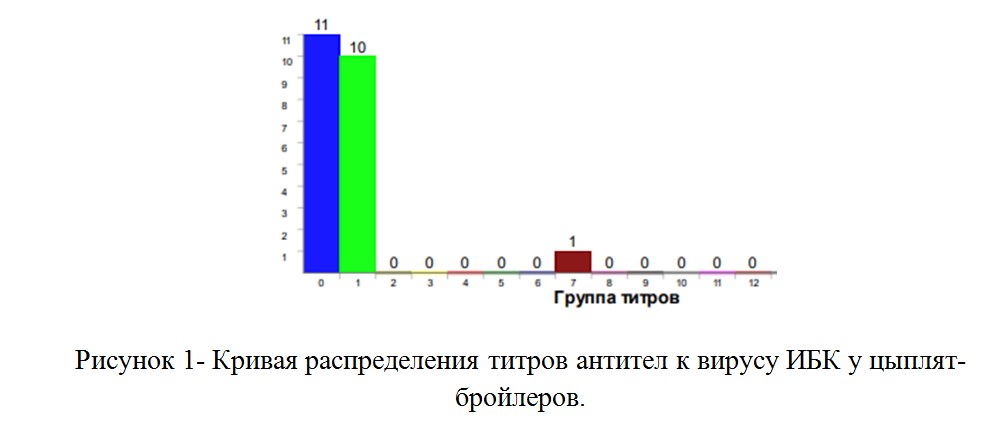
Тестирование эффективности вакцинации методом ОТ-ПЦР подтвердило, что геномная РНК вируса ИБК встречается в 40% проб кишечного содержимого, через 2 дня после вакцинации. Более того, вирус инфекционного бронхита кур был обнаружен в одной пробе кишечника, за 2 дня до вакцинации живой вакциной. У птицы с признаками везикулярного энтерита (RSS) геномная РНК вируса ИБК обнаружена не была.
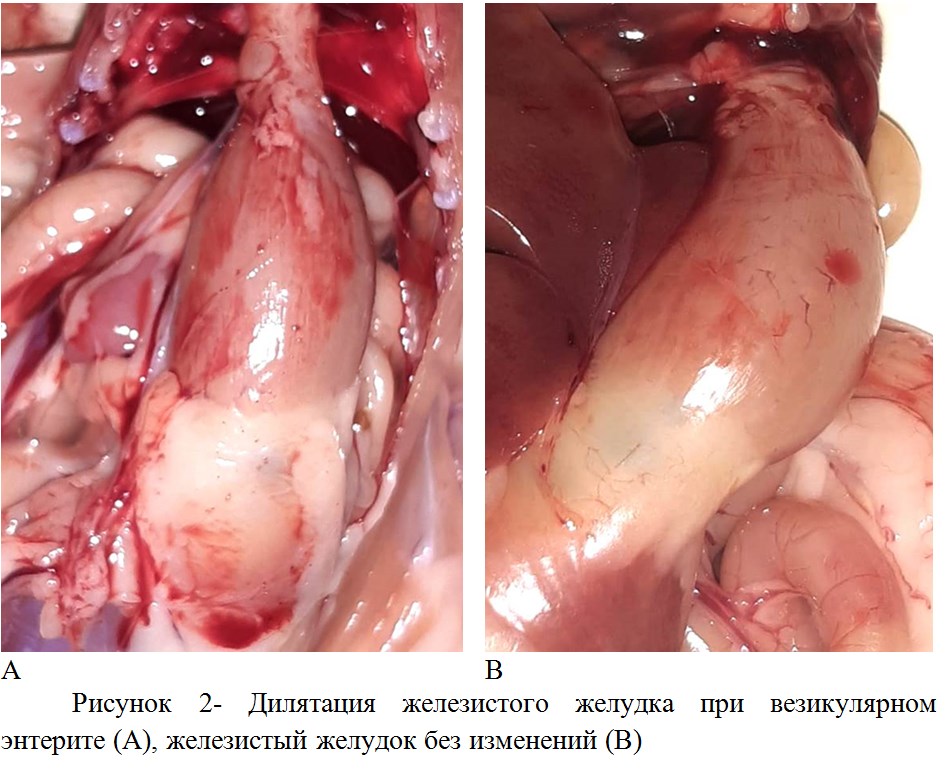
При патологоанатомическом вскрытии, у части цыплят наблюдали наличие дилятации железистого желудка (рисунок 2), - данная патология может являться одним из признаков везикулярного энтерита/RSS.
При гистологическом исследовании слизистой тощей кишки были обнаружены характерные поражения крипт, ассоциирующиеся с везикулярным энтеритом (рисунок 3а). На начальном этапе развития патологии, слизистая кишечника характеризовалась наличием кариорексиса как в эпителии крипт, так и ядер фибробластов (данный тип повреждений был впервые зафиксирован нами в РФ в 2014 г.), в кишечнике, а также гепатоцитов в печени (что сопровождалось гепатитом). В более поздний период, на месте некоторых крипт появлялись пустоты-везикулы (рисунок 3а) и нарушалась гистоархитектоника взаиморасположения крипт (рисунок 3б).
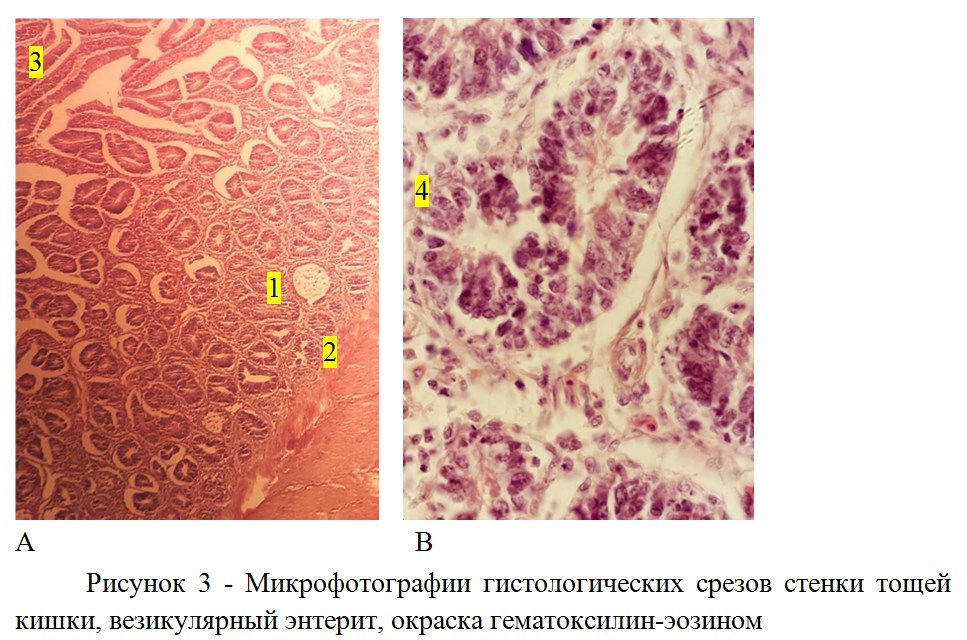
Примечание: А – разрушение отдельных крипт, везикулы (1) (х100), 2 мышечный слой, 3- ворсинки; B – нарушение гистоархитектоники крипт, за счет повреждения фибробластов, 4 – две «слившиеся крипты».
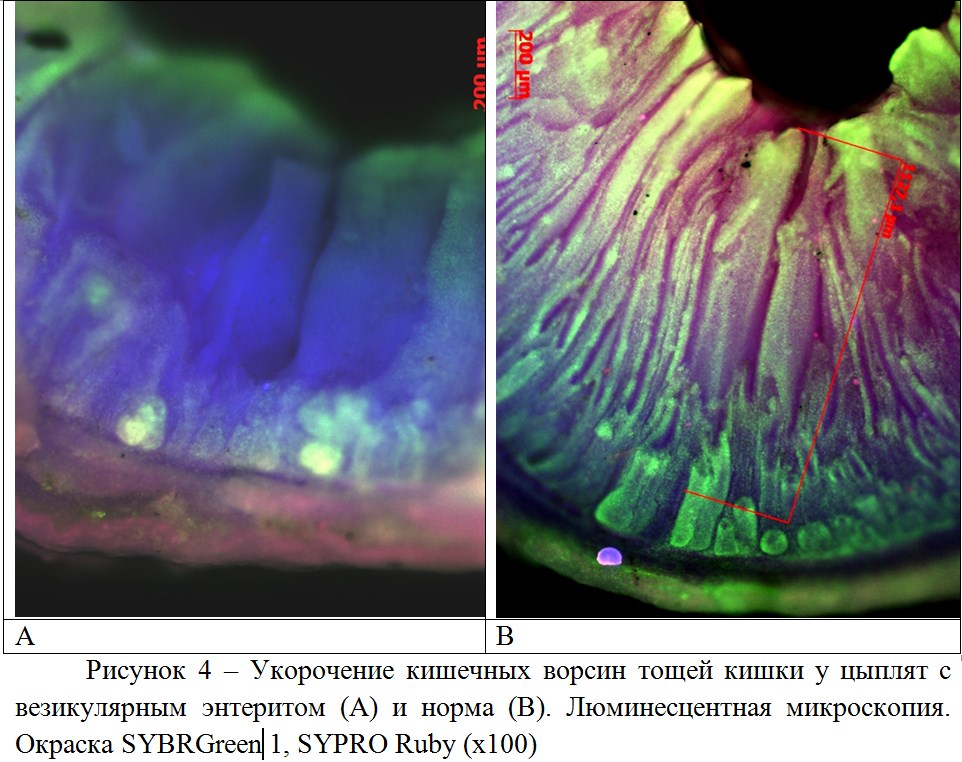
Люминесцентная микроскопия нативных кусочков слизистой тощей кишки, также позволила выявить реакцию кишечных ворсин у части цыплят-бройлеров, в возрасте 15 дней, в виде их укорочения (рисунок 4). Совокупность микроскопических исследований слизистой кишечника позволяет рассматривать выявленные нарушения в качестве основного механизма развития мальадсорбции.
Проведенные популяционно-биохимические исследования подтверждают факт наличия мальадсорбции. Как следует из анализа динамики магния и цинка, у цыплят-бройлеров в возрасте 6-10 дней появляется мальадсорбция. Всплеск уровня хлоридов в день вакцинации может быть вызван уже более глубокими нарушениями электролитного обмена и воспалением. Данный факт доказывает, что кишечник находится в воспаленном состоянии на момент вакцинации и это обязательно повлияет на качество вакцинации (см. выше).
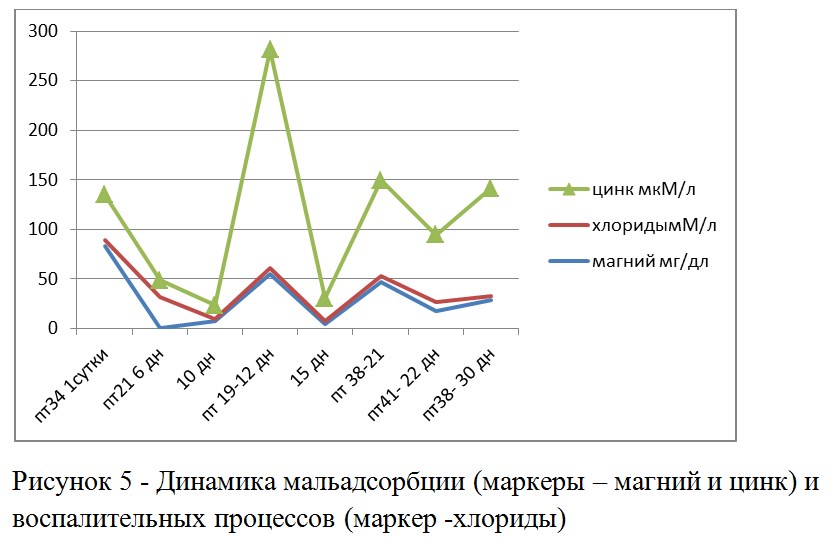
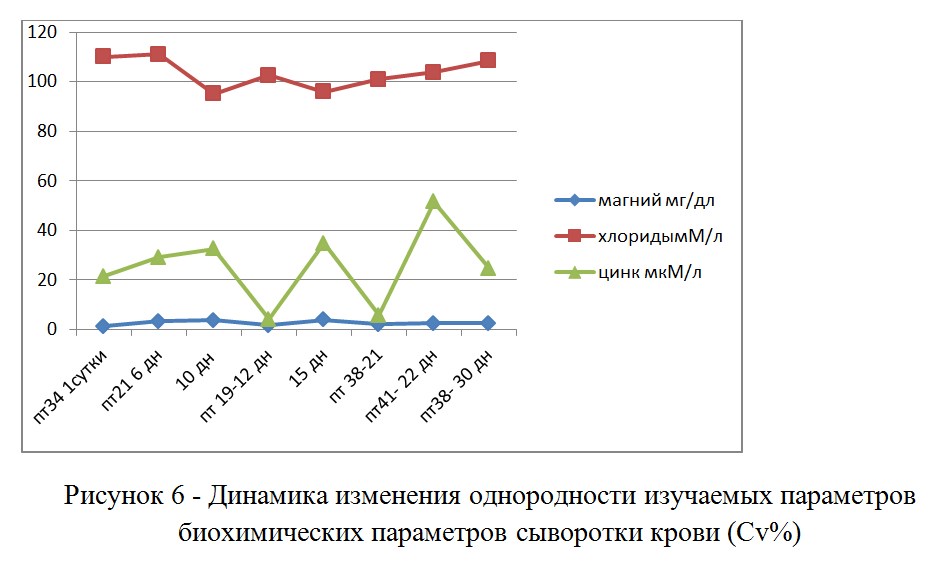
Как следует из анализа динамики изменения однородности хлоридов, в день вакцинации наблюдаются воспалительные процессы. В ситуации, когда кровь была взята до вакцинации, это можно рассматривать как фактор подавления размножения вакцинного вируса в организме. К 30 дневному возрасту этот показатель опять начинает расти. Разброс цинка и магния возрастал к 15 дню, то есть часть птицы могла, в этот период, переболевать везикулярным энтеритом (что мы наблюдали на вскрытии). Наибольшей вариабельностью обладают хлориды, стабильно, в течение всего срока наблюдения. Если рассматривать хлориды в качестве маркера лихорадочных состояний, то можно говорить о длительном контакте только части птицы с инфекционными агентами или низкой контагиозности этих агентов.
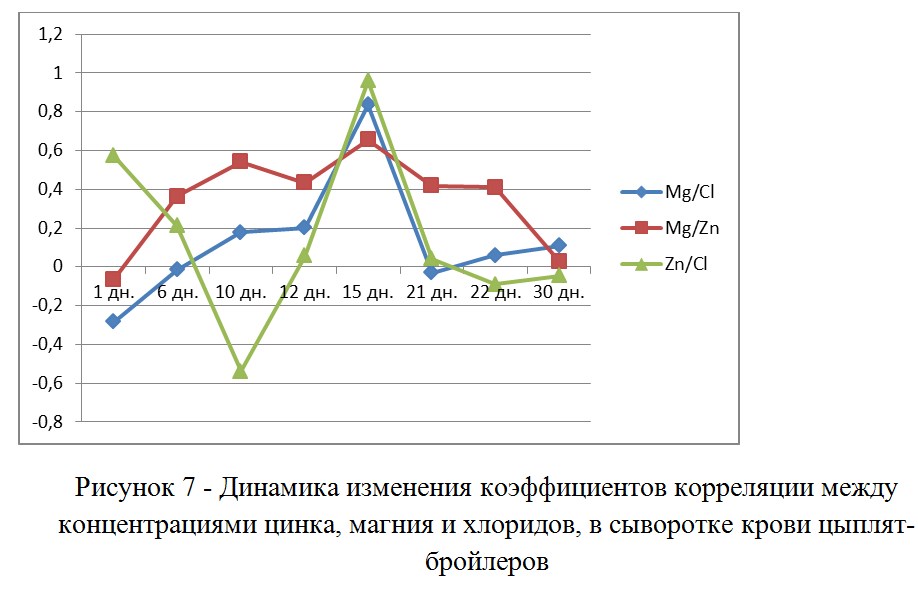
Анализ корреляции между уровнями магния и цинка в крови, позволили выявить период выращивания от 6 до 22 дней, когда эти признаки коррелируют. К 30 дневному возрасту, корреляция между цинком и магнием исчезает, - то есть, на их содержание в крови перестает влиять поврежденный кишечник.
Обсуждение
Патогенез инфекционного бронхита кур, по последним нашим исследованиям [19], имеет ряд сходных элементов с рядом коронавирусных инфекций других животных и человека, включая СOVID 19. Основное сходство заключается в преимущественном накоплении в кишечнике как IBV так и SARS CoV 2, что, в последующем, сопровождается гематогенным попаданием коронавирусов в легкие и развитием респираторной патологии [19]. Соответственно, подавление репродукции коронавирусов в кишечнике, способно оказывать существенное влияние на дальнейшее течение инфекционного процесса. В случае использования живых аттенуированных вакцинных штаммов, при вакцинации цыплят против ИБК, риски срыва вакцинации существенно возрастают, при наличии воспалительных изменений в желудочно-кишечном тракте, особенно вирусной этиологии.
Вирусная мальадсорбция может рассматриваться в качестве важнейшего фактора срыва поствакцинального иммунитета за счет интерференции полевого и вакцинного штаммов [18]. Конечно же, прививать больную птицу – нельзя. Однако, многие кишечные вирусы вызывают бессимптомное течение инфекционного процесса, сопровождающееся только мальадсорбцией и снижением привесов. Выявить период такого инфекционного процесса можно, например, путем биохимического мониторинга микроэлементов.
В проведенном исследовании можно увидеть, что вирусная мальадсорбция (рис №№ 2-4) сопровождается синхронным снижением концентрации магния и цинка в крови у больной птицы (рисунок 6). Рассматривая биохимические показатели в качестве маркеров органопатологий, мы должны применять популяционный подход к анализу данных. Более важное значение имеют даже не абсолютные значения биохимических показателей, а именно статистические характеристики отражающие распределение показателя в группе птицы и корреляцию показателей друг с другом. На графике (рис 7) можно отметить наличие корреляции концентраций в крови магния и цинка, так как физиологические функции этих микроэлементов очень различаются, то корреляция их друг с другом возможно лишь при влиянии на их концентрации общего фактора (элемента патогенеза). В данной ситуации – общим фактором является усвоение этих микроэлементов. По этой причине - именно коэффициент корреляции магния и цинка можно рассматривать в качестве наиболее валидного критерия мальадсорбции. Возможность тестирования этих показателей с использованием ИФА ридера, позволяет наиболее дешево и количественно выявлять длительность влияния на кишечник негативных факторов способных как снизить продуктивность птицы, так и повлиять на качество вакцинации через выпойку (в первую очередь против ИБК и НБ).
Оценка качества вакцинации методом ИФА и ПЦР (тестирование ПЦР превалентности через 2-3 дня после вакцинации) также, безусловно, необходимо, на начальном этапе выяснения проблемы, однако только биохимический мониторинг дает возможность контролировать саму причину срыва вакцинации, оценивать эффективность ветеринарных мероприятий нацеленных на устранение этой причины.
Выводы:
Появление везикулярного энтерита на птицефабрике совпало по времени с появлением недопривитой, против ИБК, птицы
Оценка качества вакцинации методом ОТ-ПЦР на наличие в кишечнике РНК вируса ИБК, через 2 дня после вакцинации, методом выпойки, позволяет установить резкое снижение ПЦР превалентности у птицы с везикулярным энтеритом и исключить снижение поствакцинального иммунитета.
Наиболее оптимальным путем контроля мальадсорбции является анализ изменения концентраций цинка и магний в крови цыплят-бройлеров, в динамике
Коэффициент корреляции концентраций веществ на которые влияет один и тот элемент патогенеза, следует рассматривать как наиболее информативный критерий определения маркеров оценки распространенности патологии желудочно-кишечного тракта.
Литература
5. Cavanagh D., Coronaviruses in poultry and other birds// Avian Pathol. 2005, 34: -P. 439– 448.
7. Chousalkar, K.K., Cheetham, B.F., Roberts, J.R., 2009. Effects of infectious bronchitis virus vaccine on the oviduct of hens. Vaccine 27, -P. 1485–1489.
8. Fabricant, J. 1998. The early history of infectious bronchitis. //Avian Dis. 42, -P. 648-650
10. Lucio, B., and Fabricant, J. (1990). Tissue tropism of three cloacal isolates and Massachusetts strain of infectious bronchitis virus.// Avian Dis. 34, -P. 865–870.
3. Афонюшкин В.Н., Миронова Т.Е., Черепушкина В.С. Возможный патогенез коронавирусных инфекций на примере ибк в качестве модели инфекции, ассоциированной с COVID-19 у людей// БИО. 2020. № 4 (235). С. 4-7.
11.Хатеева П.В., Афонюшкин В.Н., Сигарева Н.А. Анализ причин возникновения синдрома мальабсорбции цыплят-бройлеров на основе исследования особенностей слизистой тонкого отдела кишечника методом люминесцентной микроскопии// В сборнике: Актуальные проблемы сельского хозяйства горных территорий. материалы VI-й Международной научно-практической конференции. 2017. С. 279-282.
12. Chooi K.F., Chilian U. Broiler runting/stunting syndrome in Malaysia // Vet. Rec., 1985. 116:354
13. Афонюшкин В.Н. Ветеринары vs зоотехники, или о том, кто должен бороться с заразными заболеваниями, снижающими продуктивность птиц, на бройлерных птицефабриках//БИО. 2016 №11 (194) , -С. 4-8
14. Афонюшкин В.Н., Ширшова А.Н., Шамовская Д.В., Пломодьялов Д.Н., Козлова Ю.Н. Изучение противовирусного действия препарата тривирон на возбудителя инфекционного бронхита кур// Ветеринария. 2018. № 7. С. 24-28.
15. Бобикова А.С., Болдырева Д.С., Афонюшкин В.Н., Сигарева Н.А. Особенности структуры кишечных ворсин у мышей с метаболическим синдромом//Сибирский вестник сельскохозяйственной науки. 2017. Т. 47. № 3 (256). С. 62-67.
16.Черепушкина В.С., Афонюшкин В.Н. Определение концентрации цинка в сыворотке крови в микропланшетном формате// Сборник научных трудов Ставропольского научно-исследовательского института животноводства и кормопроизводства. 2014. Т. 2. № 7. С. 331-335.
17. Афонюшкин В.Н., Черепушкина В.С., Дударева Е,В., Донченко О.А. Концентрация цинка и магния в сыворотке крови цыплят-бройлеров как биохимический маркер для поиска причин развития у них перозиса.// БИО 2015 №1-2, -С. 10-12
18. Черепушкина В.С., Афонюшкин В.Н. Мониторинг уровня цинка в крови цыплят в качестве маркера мальабсорбции и синдрома расслоения по массе// В сборнике: Актуальные проблемы сельского хозяйства горных территорий. Материалы V-й Международной научно-практической конференции. Ответственный за выпуск: Марченко В.А., 2015. С. 142-144.
19. Миронова Т.Е., Афонюшкин В.Н., Козлова Ю.Н., Бобикова А.С., Коптев В.Ю., Черепушкина В.С., Сигарева Н.А., Колпаков Ф.А. Изучение защитных эффектов вироцидных препаратов на модели коронавирусной пневмонии// Ветеринария и кормление. 2020. № 7. С. 35-38.
Поделиться статьей в социальных сетях:
Сопровождения предприятий свиноводства и птицеводства
Мы используем ветеринарные препараты нового поколения
На вашу птицефабрику или свиноводческий комплекс
Все товары и услуги сертифицированы


