Изучение экспрессии функционально-значимых генов при терапии коронавирусной инфекции у цыплят
Изучен уровень экспрессии противовоспалительных цитокинов NF-kB, IL-6, INF-γ, Caspasa-3, Fс у кур в легких и кишечнике при моделировании инфекционного бронхита.
Для моделирования коронавирусной пневмонии вакцину вводили индивидуально, 10 доз на голову перорально. Цыплятам 1-й опытной группы скармливали препарат Люманце в расчете 3 кг/т корма, 2-й опытной – препарат Глицевир в расчете 200 мкг/0,3 мл на голову. Цыплята контрольной группы препараты не получали. Выявлено, что противовирусные препараты в опытных группах подавляли разрушение эпителиальных клеток в кишечнике. Это не всегда может свидетельствовать о позитивном характере, поскольку в случае апоптоза происходит разрушение не только пораженных вирусными частицами клеток кишечника, но и здоровых. Отмечено снижение количества активных макрофагов в кишечнике опытных групп относительно контрольной.
Количество вырабатываемого интерферона также находилось ниже контроля, что свидетельствует о пониженной активности иммунной системы. Выявлена более высокая провоспалительная активность в респираторной системе цыплят при использовании Глицевира. Она заключается в повышенном уровне экспрессии генов IL-6, интерферона-гамма, рецептора макрофагов к Fc фрагментам антител, фактора регуляции воспаления NF-kB в сравнении с препаратом Люманце, обладающим противовоспалительной активностью, но и в сравнении с цыплятами контрольной группы, не подвергавшихся лечению. Сделан вывод о возможности прогнозирования риска развития обострения инфекционного процесса в легких на фоне локального снижения вирусной нагрузки в кишечнике. Необходим комплексный подход при терапии коронавирусных инфекций, включающий или противовирусные препараты системного действия, или противовоспалительные средства.
Авторы: Бобикова А.С., Черепушкина В.С.,3Миронова Т.Е., Афонюшкин В.Н.,Донченко Н.А., Нефедова Е.В., Фуди Ян,Коптев В.Ю., Фоменко В.В.
ВВЕДЕНИЕ
В современной науке провоспалительные и противовоспалительные цитокины рассматриваются как важнейший фактор межклеточного и системного взаимодействия в организме. Цитокины – это группа эндогенных гликозилированных полипептидных медиаторов межклеточного взаимодействия, участвующих в формировании и развитии защитных реакций организма при внедрении патогенов и нарушении целостности тканей, а также в регуляции ряда нормальных физиологических функций [1].
Состояние иммунных функций организма во многом определяется соотношением провоспалительных и противовоспалительных цитокинов. Доказано существование функционального антагонизма между ними [2]. Острое возрастание уровня цитокинов в циркуляции приводит к развитию защитной системной воспалительной реакции, которую нередко называют цитокиновым штормом. Патологически высокая концентрация провоспалительных цитокинов может вызвать септический шок и гибель организма. В ситуациях, когда уровень цитокинов длительное время превышает физиологическую концентрацию, они становятся уже не медиаторами защиты, а медиаторами развития патологии [3–6]. Это обусловлено в том числе и популяционно: необходимо элиминировать организм, чтобы не произошло дальнейшего распространения патологии.
Интерлейкин 6 (IL-6) – иммунорегуляторный цитокин с широким спектром действия: он регулирует процессы воспаления и клеточного деления. IL-6 синтезируется из макрофагов, Т-клеток, фибробластов, эндотелиальных клеток сосудов, глиальных и эпителиальных клеток после взаимодействия с патогенными молекулами. При формировании иммунного ответа интерлейкин 6 участвует в выработке антител. Избыток этого цитокина приводит к развитию аутоиммунной реакции и повреждению тканей [7].
Каспазы – семейство цистеиновых протеаз, которые участвуют в расщеплении пептидных связей. Экспрессия каспаз-3, -8, -9 является показателем цитотоксичности апоптотического стимула, что делает эти маркеры важной частью исследований, касающихся процессов апоптоза в организме [8].
Клетки иммунной системы взаимодействуют друг с другом с использованием цитокинов – модуляторов иммунных реакций. Среди них важное место занимают интерфероны. Они обладают противовирусным и антибактериальным действием, участвуют в противоопухолевом иммунном ответе [9]. INF-γ, как и большинство цитокинов, обладает плейотропным действием и играет важную роль в иммунном ответе. Первоначально считалось, что INF-γ продуцируется только натуральными киллерами (NK), CD4 + Тh1-лимфоцитами и цитотоксическими CD + Т-лимфоцитами. Позднее стало известно, что В-лимфоциты, NKT-клетки и антигенпрезентирующие клетки (APC) (макрофаги, дендритные клетки) также способны секретировать данный цитокин [10].
NF-kB обнаружен почти во всех типах клеток животных и участвует в клеточных реакциях на раздражители: стресс, цитокины, свободные радикалы, тяжелые металлы, ультрафиолетовое облучение, окисленные ЛПНП, а также бактериальные или вирусные антигены. NF-kB играет ключевую роль в регулировании иммунного ответа на инфекцию [11, 12].
Антивирусный эффект лекарств часто выявляется с помощью qRT-PCR [13–15], IFA [16, 17].
В нескольких сообщениях указывается, что сигнальные пути MDA5 и цитокины врожденного иммунитета активируются после инфицирования штаммом IBV M41 [18]. Путь передачи сигналов MDA5 нарушен расщеплением адаптерного белка MAVS в штамме инфекции IBV JS/2010/12 [19]. Ответ INF типа I играет решающую роль в сопротивлении штамму SAIBK2 IBV [20]. Сигнальные пути MDA5 и цитокин врожденного иммунитета (NF-kB и IRF3) индуцировались после инфицирования штаммом IBV-M41 [17]. Исследователями обнаружено, что уровни экспрессии мРНК MDA5, MAVS, INF-α, INF-β, NF-kB, TNF-α и IL-6 значительно повышены после инфицирования IBV in vitro и in vivo [18]. Цель исследования – оценить экспрессию генов IL-6, Fс, NF-kB, Caspasa-3 и INF-γ на фоне коронавирусной инфекции у цыплят.
МАТЕРИАЛЫ И МЕТОДЫ
Цыплята кросса Шавер в возрасте 14 сут были вакцинированы против инфекционного бронхита кур (вакцина против ИБК, штамм Ma5, живая сухая). Для моделирования коронавирусной пневмонии вакцину вводили индивидуально, 10 доз на голову перорально. Цыплятам 1-й опытной группы (n = 10) скармливали препарат Люманце в расчете 3 кг/т корма, 2-й опытной (n = 10) – препарат Глицевир (производное глицирризиновой кислоты в составе наночастиц хитозана) в расчете 200 мкг/0,3 мл на голову. Концентрат разводили в 3 раза. Цыплята контрольной группы (n = 11) препараты не получали.
На 22-е сутки осуществляли убой птицы методом цервикально-церебральной дислокации и проводили патологоанатомическое вскрытие птиц. Из внутренних органов методом фенолхлороформной экстракции выделяли РНК, осуществляли ОТ-ПЦР. Синтез кДНК проводили с использованием олигонуклеотида N7.
Для подтверждения успешности заражения тестировали наличие геномной РНК вируса ИБК методом ОТ-ПЦР в режиме реального времени, ПЦР проводили в конечном объеме 20 мкл, содержащем 67 мМ трис.-HCl (рН 8,9), 16 мМ (NH4 )2SO4 , 2,4 мМ MgCl2, 0,01% Твин 20, 0,2 mM дНТФ, 0,3 mкM растворы олигонуклеотидных праймеров 5`-atgctcaaccttgtccctagca-3` 5`tcaaactgcggatcatcacgt-3` и зонда FAMtggaagtagagtgacgcccaaac-BHQ, 1–2 ед. HotStart Taq-ДНК полимеразы. ПЦР проводили на амплификаторе CFX (BiоRad) по следующей программе: начальная денатурация – 95 °С (15 мин), далее 40 циклов: денатурация – 95 °С (10 с), отжиг – 60 °C (30 с).
Контроль выделяемости РНК из образцов осуществляли с использованием ПЦР в режиме реального времени специфичного в отношении мРНК гена домашнего хозяйства glyceraldehyde3-phosphate dehydrogenase (GAPDH) по протоколу, указанному выше, с использованием праймеров 5`cgtgaccccagcaacatcaa3` и 5` acttaccccagccttctccat3` taqman зонда ROXtggagtccactggtgtcttcacc- BHQ2. Экспрессию генов IL-6, Fс, NF-kB, Caspasa-3, INF-γ оценивали методом дельтадельта Ct относительно уровня экспрессии генов домашнего хозяйства (см. таблицу).

РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Препараты Люманце и Глицевир подавляли разрушение эпителиальных клеток в кишечнике опытных групп (см. рис. 1). Это не всегда свидетельствует о позитивном характере, поскольку в случае апоптоза происходит разрушение не только здоровых, но и зараженных клеток. Отмечено снижение количества активных макрофагов в кишечнике относительно контрольной группы. Количество вырабатываемого интерферона также находилось ниже контроля, что свидетельствует о пониженной активности иммунной системы.
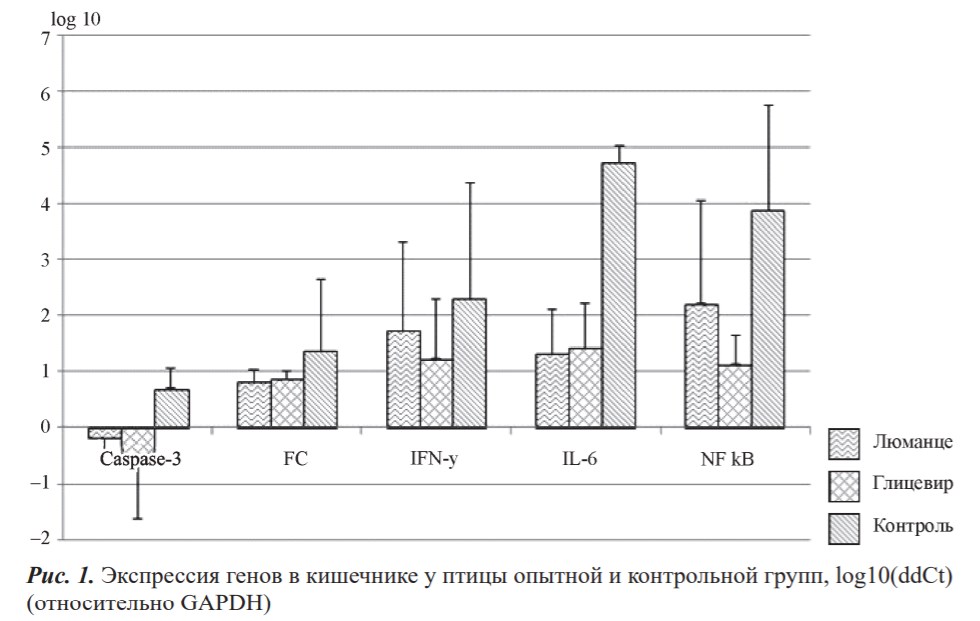
Препарат Глицевир состоит из наночастиц, которые не всасываются в кишечнике, и обладает местным действием. Препарат Люманце может всасываться, поскольку содержит соли масляной кислоты и помимо местного обладает и системным действием. В кишечнике оба препарата снизили вирусную нагрузку.
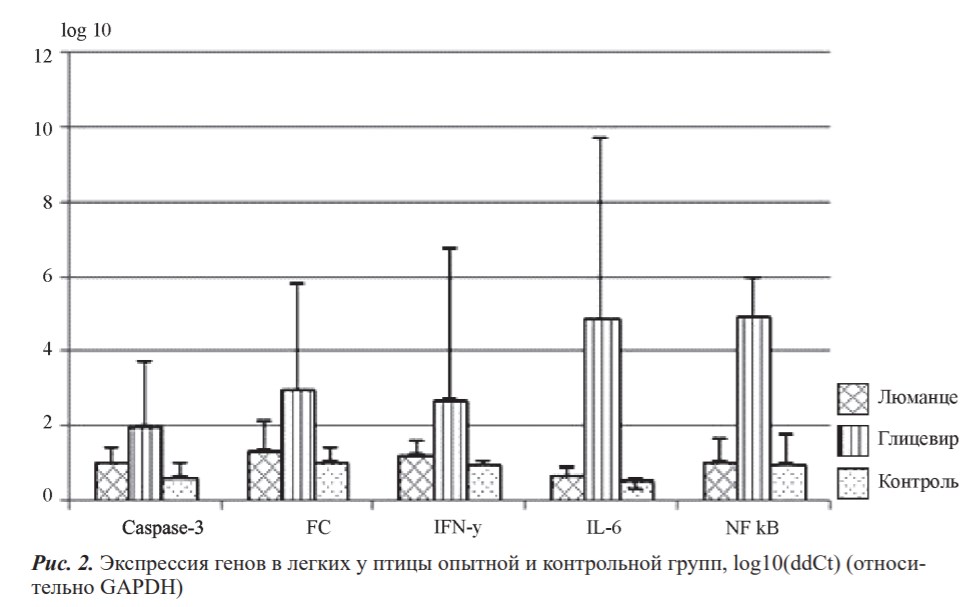
Препарат Глицевир спровоцировал более интенсивную экспрессию генов, участвующих в иммунном ответе и воспалении, что характеризуется повышенным уровнем NF-kB, IL-6, INF-γ (большее количество Т-хеллперов встречается с вирусными частицами), Fc (большее количество макрофагов) и Caspasa-3 (клетки в легких разрушаются интенсивнее) (см. рис. 2).
О подавлении разрушения эпителиальных клеток опытными препаратами также свидетельствует пониженная удельная доля Fc-фрагмента относительно контрольной группы. Fc-рецептор присутствует на макрофагах и отвечает за связывание антител с макрофагом. Можно утверждать о снижении количества активных макрофагов в кишечнике относительно контрольной группы. Каспазы играют важную роль в развитии и регуляции апоптоза и воспалительных процессов. В данном случае (поскольку сам коронавирус не влияет на разрушение клеток) происходит разрушение пораженных клеток иммунными агентами, например Т-киллерами.
При взаимодействии Т-хелпера с антигеном вырабатывается интерферон гамма (INF-γ), который является провоспалительным цитокином и активирует множество клеток (Т-клетки, В-клетки и др.). В кишечнике количество вырабатываемого интерферона снижено, это также свидетельствует о пониженной активности иммунной системы.
Интерлейкин-6 является провоспалительным цитокином, количество которого напрямую влияет на развитие цитокинового шторма. IL-6 создает в организме условия сверхнагрузки иммунной системы, и возникают два пути развития: элиминация возбудителя в полной мере или элиминация самого зараженного животного [7, 11]. В момент, когда вирусные антигены встречается с толл-лайк рецепторами, активируется NF-kB, который, в свою очередь, является пусковым механизмом как для врожденного иммунного ответа (миграция макрофагов и др.), так и для адаптивного иммунитета (выработка антител, формирование Т-клеток). NF-kB – наиболее ранний фактор и наиболее активно эксплуатируется при коронавирусных инфекциях. Это проявляется аномально длительной миграцией нейтрофилов, гранулоцитов в очаг воспаления, их активизацией, а также повышенной пролиферацией, в то время как при обычной инфекции имеется лишь короткий период, когда нейтрофилы осуществляют борьбу с первичным очагом заражения. Этот механизм может впоследствии привести к лейкотриеновому шторму, в дальнейшем – к цитокиновому.
Глицирризиновая кислота оказывает противовирусное, противовоспалительное, противозудное и иммуномодулирующее действие, влияет на разные типы ДНК и РНК вирусов in vitro и in vivo, прерывает репликацию вирусов на ранних стадиях, вызывает выход вириона из капсида, не допуская его проникновения в клетки, что связано с селективным дозозависимым ингибированием фосфорилирующей киназы. Глицирризиновая кислота взаимодействует со структурами вируса, изменяя различные фазы вирусного цикла, что сопровождается необратимой инактивацией вирусных частиц, находящихся в свободном состоянии вне клеток, блокирует внедрение активных вирусных частиц внутрь клетки, нарушает способность вируса к индукции синтеза новых вирусных частиц, индуцирует образование интерферона, что является одним из компонентов противовирусного действия, инактивирует указанные вирусы в нетоксичных для нормально функционирующих клеток концентрациях. Противовоспалительная активность глицирризиновой кислоты сочетается со стимулирующим влиянием на гуморальные и клеточные факторы иммунитета1
Различия между активностью препаратов с наличием резорбтивного эффекта (Люманце) и его отсутствием (Глицевир в составе наночастиц хитозана) заключаются в более высокой провоспалительной активности в респираторной системе при использовании Глицевира. Она заключается в повышенном уровне экспрессии генов IL-6, интерферона-гамма, рецептора макрофагов к Fc фрагментам антител, фактора регуляции воспаления NF-kB не только в сравнении с препаратом Люманце, обладающим заведомо противовоспалительной активностью благодаря наличию в составе масляной кислоты, но и в сравнении с контрольной группой цыплят, не подвергавшихся лечению.
Нами предложены две гипотезы о действии препаратов на пораженный кишечник:
- оба препарата уменьшают воспаление в кишечнике через подавление иммунореактивности и, как следствие, снижают иммунный ответ;
- препараты снижают вирусную нагрузку, соответственно происходит менее интенсивная презентация вирусных антигенов, меньше вырабатывается иммунокомпетентных клеток.
При любой из этих гипотез Глицевир оказывал подавляющее действие на воспалительные процессы в кишечнике, не влияя на легкие (см. рис. 1).
В качестве основной версии рассматривается снижение активности иммунокомпетентных клеток в составе желудочно-кишечного тракта, в первую очередь – Treg лимфоцитов (активных продуцентов противовоспалительного цитокина IL10) в связи с подавлением инфекционного процесса локально, по месту действия Глицевира, т.е. в кишечнике. В пользу этого предположения свидетельствует подавление активности экспрессии гена IL-6, прямого антагониста провоспалительного цитокина IL10 и клеток, продуцирующих данный интерлейкин. Вся кровь и лимфа из желудочно-кишечного тракта обязательно проходят через легкие, т.е. практически без разбавления, поэтому вклад регуляторной активности иммунной системы кишечника в отношении иммунокомпетентных клеток легких должен быть существенным. Таким образом, можно спрогнозировать риск развития обострения инфекционного процесса в легких на фоне локального снижения вирусной нагрузки в кишечнике, что требует комплексного подхода в терапии коронавирусных инфекций, включающего или противовирусные препараты системного действия, или противовоспалительные средства.
ВЫВОДЫ
- На модели коронавирусной инфекции обнаружено статистически значимое подавление экспресии провоспалительного цитокина IL-6 (p
- Применение препарата Глицевир в составе наночастиц хитозана, ограничивалось локальным действием что характеризовалось отсутствием подавления провоспалительных цитокинов в легких и, напротив, отличалось от действия Люманце повышением дисперсии уровней экспрессии исследуемых генов и средними уровнями прироста экспрессии генов IL-6, NF-kB, INF-γ (провоспалительных цитокинов) и Caspasa-3, Fc-фрагментов в ткани легких.
- Для снижения рисков обострения пневмоний при коронавирусных инфекциях применение противовирусных препаратов местного действия в кишечнике должно подразумевать использование противовоспалительных препаратов системного действия.
СПИСОК ЛИТЕРАТУРЫ
- Кетлинский С.А. Цитокины: монография. СПб.: Фолиант, 2008. С. 9–22.
- Перцов С.С., Коплик Е.В., Калиниченко Л.С. Действие интерлейкина-1β и интерлейкина-4 на альбуминовые показатели крови у крыс с разной поведенческой активностью // Российский физиологический журнал им. И.М. Сеченова. 2011.Т. 97. С. 276–282.
- Симбирцев А.С. Иммунофармакологические аспекты системы цитокинов // Бюллетень сибирской медицины. 2019. С. 84–95. DOI: 10.20538/1682-0363-2019-1-84-95.
- Balkwill F.R., Burke F. Immunology Today // Immunology Today. 1989. Vol. 10. P. 299–304.
- Paul W.E. Pleiotrophy and redundancy: T cell derived lymphokines in the immune response // Cell. 1989. N 57. Р. 521–524.
- Arai K., Lee E., Miyajima A. Cytokines: coordinators of immune and inflammatory responses // Annual Review of Biochemistry. 1990. Vol. 59. P. 783–836.
- Петинати Н.А., Шипунова И.Н., Бигильдеев А.Е. Анализ экспрессии генов, участвующих в модуляции иммунного ответа, в неактивированных мультипотентных мезенхимальных стромальных клетках // Бюллетень экспериментальной биологии и медицины. 2012. № 2. С. 211–216.
- Дятлова А.С., Дудков А.В., Линькова Н.С. Молекулярные маркеры каспаза-зависимого и митохондриального апоптоза: роль в развитии патологии и в процессах клеточного старения // Успехи современной биологии. 2018. Т. 138. № 2. С. 126–137.
- Bufe A., Gehlhar K., Grage-Griebenow E. Atopic phenotype in children is associated with decreased virus-induced interferon-alpha release // International Archives of Allergy and Immunology. 2002. Vol. 127. N 1. P. 82–85.
- Schoenborn J.R., Wilson C.B. Regulation of interferon-gamma during innate and adaptive immune responses // Advances in Immunology. 2007. Vol. 96. P. 41–101.
- Серебренникова С.Н., Семинский И.Ж. Основные регуляторные цитокины и их эффекты // Животноводство и ветеринария Сибирский вестник сельскохозяйственной наyки • 2021 • 51 • 5 75 Бобикова А.С., Черепушкина В.С., Миронова Т.Е., Афонюшкин В.Н., Донченко Н.А., Нефедова Е.В., Фуди Ян, Коптев В.Ю., Фоменко В.В. Изучение экспрессии функционально-значимых генов при терапии коронавирусной инфекции у цыплят Патофизиология воспалительного процесса. Иркутск, 2014. С. 20–27.
- Liu T., Zhang L., Joo D., Sun S.C. NF-κB signaling in inflammation. // Signal Transduct Target Ther. 2017. Vol. 2. N 17023. DOI: 10.1038/ sigtrans.2017.23.
- Schnepf N., Boiteau N., Petit F. Rapid determination of antiviral drug susceptibility of human cytomegalovirus by real-time PCR // Antiviral Research. 2009. Vol. 81. P. 64– 67. DOI: 10.1016/j.antiviral.2008.09.009.
- Li H., Wu J., Zhang Z. Forsythoside a inhibits the avian infectious bronchitis virus in cell culture // Phytotherapy Research. 2011. Vol. 25. P. 338– 342. DOI: 10.1002/ptr.3260.
- Zhang P., Liu X., Liu H. Astragalus polysaccharides inhibit avian infectious bronchitis virus infection by regulating viral replication // Microbial Pathogenesis. 2018. Vol. 114. P. 124–128. DOI: 10.1016/j.micpath.2017.11.026.
- Xu X., Guo H., Xiao C. In vitro inhibition of classical swine fever virus replication by siRNAs targeting Npro and NS5B genes // Antiviral Research. 2008. Vol. 78. P. 188–193. DOI: 10.1016/j.antiviral.2007.12.012.
- Zhang W., Bouwman K.M., Van Beurden S.J. Chicken mannose binding lectin has antiviral activity towards infectious bronchitis virus // Virology. 2017. Vol. 509. P. 252–259. DOI: 10.1016/j.virol.2017.06.028.
- He Y., Xie Z., Dai J. Responses of the toll-like receptor and melanoma differentiation-associated protein 5 signaling pathways to avian infectious bronchitis virus infection in chicks // Virologica Sinica. 2016. Vol. 31. P. 57–68. DOI: 10.1007/ s12250-015-3696-y.
- Yu L., Zhang X., Wu T. Avian infectious bronchitis virus disrupts the melanoma differentiation associated gene 5 (MDA5) signaling pathway by cleavage of the adaptor protein MAVS // BMC Veterinary Research. 2017. N 13. Vol. 332. P. 1–11. DOI: 10.1186/s12917-017-1253-7.
- Chen H., Muhammad I., Zhang Y., Ren Y., Zhang R., Huang X., Diao L., Liu H., Li X., Sun X., Abbas G., Li G. Antiviral Activity Against Infectious Bronchitis Virus and Bioactive Components of Hypericum perforatum // Frontiers in Pharmacology. 2019. Vol. 10. N 1272. DOI: 10.3389/fphar.2019.01272.
- Cheng P., Wang T., Li W. Baicalin Alleviates Lipopolysaccharide-Induced Liver Inflammation in Chicken by Suppressing TLR4-Mediated NFκB Pathway // Frontiers in Pharmacolog. 2017. N 547. P. 1–12. DOI: 10.3389/fphar.2017.00547.
- Sun X., Wang Z., Shao C., Yu J., Liu H., Chen H., Li L., Wang X., Ren Y., Huang X., Zhang R., Li G. Analysis of chicken macrophage functions and gene expressions following infectious bronchitis virus M41 infection. Vet Res. 2021. Vol. 52. N 1. DOI: 10.1186/s13567-021-00896-z
-----------------------------------
Сноски:
1 - Пат. РФ № 2044145 (Российская Федерация). Ди- и триникотинаты глицирризиновой кислоты и ингибитор репродукции вируса иммунодефицита человека / Г.А. Толстикова, Л.А. Балтина, К.П. Волчо, О.А. Плясунова, А.Г. Покровский, Н.Ф. Салахутдинов. Опубл. 10.08.2007. Бюл. № 22.
Поделиться статьей в социальных сетях:
Сопровождения предприятий свиноводства и птицеводства
Мы используем ветеринарные препараты нового поколения
На вашу птицефабрику или свиноводческий комплекс
Все товары и услуги сертифицированы


