Научно-практические аспекты инфекционной анемии цыплят
Инфекционная анемия цыплят. Научно-практические аспекты.
Дмитриева М.Е.
мкандидат ветеринарных наук, советник генерального директора по биологической безопасности ПАО «Птицефабрика «Боровская» Тюменской области
Балендор Е.В.
начальник Департамента ветеринарии Министерства сельского хозяйства Калининградской области, заместитель министра сельского хозяйства Калининградской области, главный госветинспектор Калининградской области
Промышленное птицеводство – это наиболее интенсивно развивающаяся отрасль животноводства, которая способна в короткие сроки обеспечить население высококачественными продуктами питания животного происхождения. Но с увеличением объемов производства возрастают риски возникновения и распространения инфекционных болезней различной этиологии. В настоящее время наблюдается расширение спектра инфекционных болезней, возврат «старых» инфекций, течение болезней в субклинической, латентной, атипичной и ассоциированной форме. Актуальной проблемой в промышленном птицеводстве является распространение иммунодепрессивных болезней, в том числе инфекционной анемии цыплят (ИАЦ).
Болезнь широко распространена в странах с развитым промышленным птицеводством, а в последнее десятилетие получила широкое распространение в Российской Федерации. Антитела к вирусу ИАЦ выявляются в пробах сыворотки крови не только в промышленных хозяйствах мясного и яичного направления, но и в племенных и фермерских хозяйствах. Болезнь наносит серьезный экономический ущерб, который складывается из потерь от падежа птицы, снижения продуктивности, затрат на антибактериальные, витаминно-минеральные препараты и потерь от снижения качества мясной продукции.
Возбудитель ИАЦ обладает иммуносупрессивными свойствами и играет важную роль в этиологии ряда многофакторных болезней вирусной, бактериальной и паразитарной этиологии. Возбудители иммунодепрессивных болезней вызывают разрушение клеток и целых звеньев иммунной системы, что приводит к повышению восприимчивости организма птицы к другим патогенам, затрудняет диагностику, снижет эффективность профилактики (в том числе специфической) и лечения инфекционных болезней. Методы профилактики и борьбы с ИАЦ, а также средства для серологической диагностики и специфической профилактики болезни в России до настоящего времени не разработаны.
Впервые возбудитель ИАЦ был выделен и описан Yuasa N. et all [1] в 1979 году. В 1993 году на пленарной сессии Международного комитета по таксономии вирусов (МКТВ) вирус инфекционной анемии цыплят (ВАЦ) был отнесен к семейству Circoviridae роду Circovirus [2]. В 1999 году ВАЦ был выделен в отдельный род Gyrovirus [2,3]. Геном ВАЦ отличается от других представителей семейства Circoviridae отсутствием репликативного белка. В 2015 году на сессии МКТВ вирус ИАЦ был отнесен к семейству Anelloviridae [4,5]. Анализ структуры генома показал, что ВАЦ имеет такие же особенности, как вирусы Torque Teno (TTV) [2,6,7,8,9,10] и мини-вирус Torque Teno (TTMV) человека, которые являются членами рода Anellovirus [2,6,7,9,11]. Величина вируса варьирует от 18 до 26,5 нм [12]. Геном вируса представлен циркулярной однонитчатой минус-ДНК [13], содержащей 2,3 тысячи пар нуклеотидов [14]. Вирус представляет собой правильный Т-3 икосаэдр, капсид которого включает 32 капсомера. Все штаммы вируса генетически подобны, принадлежат к одному серотипу [15,16,17], но различаются по вирулентности [16,18,19]. В геноме вируса различают три открытые рамки считывания (ORF). ORF1 (1347 н.п.) кодирует основной вирусный структурный белок VP1 (52 кДа) и частично перекрывается с ORF2 (648 н.п.), кодирующей белок VP2 (24 кДа). ORF3 (363 н.п.) кодирует неструктурный белок апоптин (13,6 кДа) [20,21,22,23,24], который способен индуцировать апоптоз в тимоцитах кур, в лимфобластоидных клеточных линиях кур [22], в некоторых злокачественных лимфобластоидных клеточных линиях [23] и клетках остеосаркомы человека [24]. Белок VP3 связан с инфицированными клетками и необходим для репликации вируса [3]. Белок VP1 является структурным белком и основным белком капсида [25]. Мутации в определенном положении белка VP1, непосредственно влияют на патогенный потенциал вируса [26-29]. Белок VP2 выполняет связующую функцию в процессе сборки вирионов для достижения VP1 определенной конформации [30]. Как и VP1, белок VP2 незаменим для репликации вируса [31,32,33,34]. Он также обладает антигенной активностью и отвечает за выработку вируснейтрализующих антител (ВНА) [33]. У цыплят репликация вируса происходит преимущественно в гемоцитобластах в костном мозге и предшественниках Т-клеток в коре тимуса [35,36]. Репликация вируса в клетках коры тимуса приводит к их гибели в результате апоптоза [37]. ВАЦ также может реплицироваться в лимфоцитах других органов [38].
Для репродукции, выделения in vitro и титрования ВАЦ используют клеточные культуры MDCC-MSB1, клеточные культуры MDCC-JP2 и другие лимфобластоидные линии Т-клеток и В-клеток [13,18,25]. Репродукция вируса в СПФ-куриных эмбрионах не вызывает у эмбрионов патологических изменений и гибели [13,19]. Для репродукции вируса можно использовать суточных цыплят, не имеющих пассивных антител к ВАЦ [12,25]. Экспериментальная инфекция легко воспроизводится при заражении СПФ-цыплят раннего возраста гомогенатом печени, отобранной от больных и павших от ИАЦ птиц и проявляется отставанием в росте и развитии, апластической анемией и атрофией лимфоидных органов [13]. Наиболее высокая концентрация вируса отмечается в печени [25] с 7 по 21 сутки после заражения с максимальным пиком на 6-7 сутки [39]. У цыплят, выведенных из инфицированного яйца, в 5-8-суточном возрасте наблюдается анемия костного мозга, а также отмечаются случаи геморрагического воспаления фабрициевой сумки [40]. ВАЦ легко распространяется при контакте, воздушно-капельным путем, через инфицированные воду и корма, через предметы ухода, оборудование, подстилку, со спермой инфицированных петухов [18,41].
Возбудитель ИАЦ обладает высокой устойчивостью к физическим и химическим факторам внешней среды, дезинфектантам, что позволяет ему длительное время сохраняться в птицеводческих помещениях, способствует его повсеместному распространению и затрудняет контроль за инфекцией [25,36,42,43,44].
Долгое время считалось, что вирус ИАЦ инфицирует только кур, однако антитела к ВАЦ были выявлены у японских перепелов [45], у домашних воробьев (Passer domesticus) [46], индеек [32]. Куры являются естественными хозяевами ВАЦ, но по данным L. Fang et al. [47] варианты вируса ИАЦ были выделены от мышей, кошек, собак и человека.
Вирус передается горизонтально фекально-оральным путем и вертикально [32,44,48,49], со спермой, полученной от инфицированных петухов [4,41,45], через респираторный тракт [50,51], через контаминированные ВАЦ вакцины [13,18,50]. Вирус ИАЦ содержится в стержнях пера инфицированных птиц, перхоти и, следовательно, перо также является фактором передачи вируса [52,53]. Факторами передачи вируса из одного хозяйства в другое являются люди, одежда, инвентарь, тара, транспорт [54].
Наиболее восприимчивы к ИАЦ цыплята до 2-недельного возраста. Однако возрастная устойчивость снижается при коинфекции ВАЦ с иммунодепрессивными агентами, такими как вирусы инфекционной бурсальной болезни (ИББ), болезни Марека (БМ) и ретикулоэндотелиоза [45]. Признаки болезни наиболее выражены у цыплят мясных кроссов [55], но в настоящее время признаки ИАЦ нередко выявляются и на яичной птице.
При естественном заражении сероконверсия отмечается через 2-4 недели [25,56]. Однако часть (10% и более) переболевшей птицы остается серонегативной. Данный феномен можно объяснить наличием у части особей иммунологической толерантности к ВАЦ [12,18].
При естественном заражении у цыплят-бройлеров отмечают 3 пика смертности: в возрасте 12-14 суток, вследствие трансовариальной передачи, в возрасте 22-26 суток, в результате горизонтального распространения вируса и при значительном инфицировании стада в возрасте 32-35 суток. У молодняка кур-несушек и ремонтного молодняка племенных стад повышение смертности наблюдается в возрасте 10-16 недель. Вследствие иммунодепрессивного действия ВАЦ в этот период на вакцинированном поголовье могут возникать локальные вспышки кокцидиоза, болезни Марека, инфекционного бронхита кур (ИБК). В продуктивный период ИАЦ у кур сопровождается анемией гребня и сережек, а также повышением смертности с признаками бактериальных инфекций [12].
Клетками-мишенями для вируса ИАЦ являются предшественники эритроцитов, тромбоцитов, моноцитов, гранулоцитов, Т-лимфоцитов и опосредованно В-лимфоцитов. В организме инфицированных цыплят макрофаги теряют способность продуцировать интерлейкин-1, индуктор противовоспалительного процесса [12]. Угнетение продукции интерлейкина-1, уменьшение количества Fc-рецепторов и фагоцитарной активности снижает защитную функцию иммунной системы и способствует возникновению вторичных инфекций [59,60].
В основном репликация ВАЦ происходит в макрофагах и моноцитах с развитием иммуносупрессии [61], а также в лимфобластах коркового слоя тимуса, интрасиноидальных и экстрасиноидальных гемоцитобластах, ретикулярных клетках. Антиген вируса выявляется в зрелых Т-лимфоцитах, в селезенке и тканях других лимфоидных органов [37,38]. Появление новой генерации Т-лимфоцитов, проэритробластов и промиелоцитов в костном мозге, восстановление кроветворной функции костного мозга можно наблюдать через 16 суток после заражения ВАЦ, что совпадает с началом образования вируснейтрализующих антител [25].
Развитие поствакцинального или постинфекционного иммунитета снижает диссиминацию вируса ИАЦ, но не блокирует его репликацию в организме птиц [56]. Возбудитель может сохраняться длительное время в репродуктивных органах и передаваться трансовариально, вызывая иммуносупрессию у молодняка. Вируснейтрализующие антитела не являются препятствием для персистенции вируса в репродуктивных органах [48,62]. Снижение уровня лимфоцитов приводит к повышению восприимчивости птицы к инфекциям, вызываемым реовирусами, вирусом ньюкаслской болезни (НБ), аденовирусами [63], вирусами БМ, ИББ [64], ретикулоэндотелиоза [65], бактериями из родов Streptococcus, Staphylococcus, Clostridium, Salmonella spp., Escherichia [54], а также к Cryptosporidium baileyi [66], патогенам грибковой этиологии [25]. Тромбоцитопения вследствие нарушения целостности стенок сосудов играет ведущую роль в патогенезе возникновения предрасположенности к другим патогенам [67].
ВАЦ вызывает депрессию поствакцинального иммунного ответа против вирусов НБ, БМ, инфекционного ларинготрахеита птиц (ИЛТ), гриппа птиц [3,68], ИББ, ИБК, эймерий [12,69,70]. У цыплят, инфицированных или переболевших ИАЦ, иммунитет после применения живой вакцины против НБ из штамма «Ла-Сота» ниже на 40% и более по сравнению с цыплятами, свободными от ВАЦ [70,71], а после иммунизации инактивированной вакциной против НБ - на 4,6 log2 [72]. Это подтверждается и нашими исследованиями, проведенными в условиях промышленного птицеводческого предприятия. Было установлено снижение иммунного ответа на вакцинацию против инфекционной бурсальной болезни.
Результаты исследований представлены на рисунке 1.
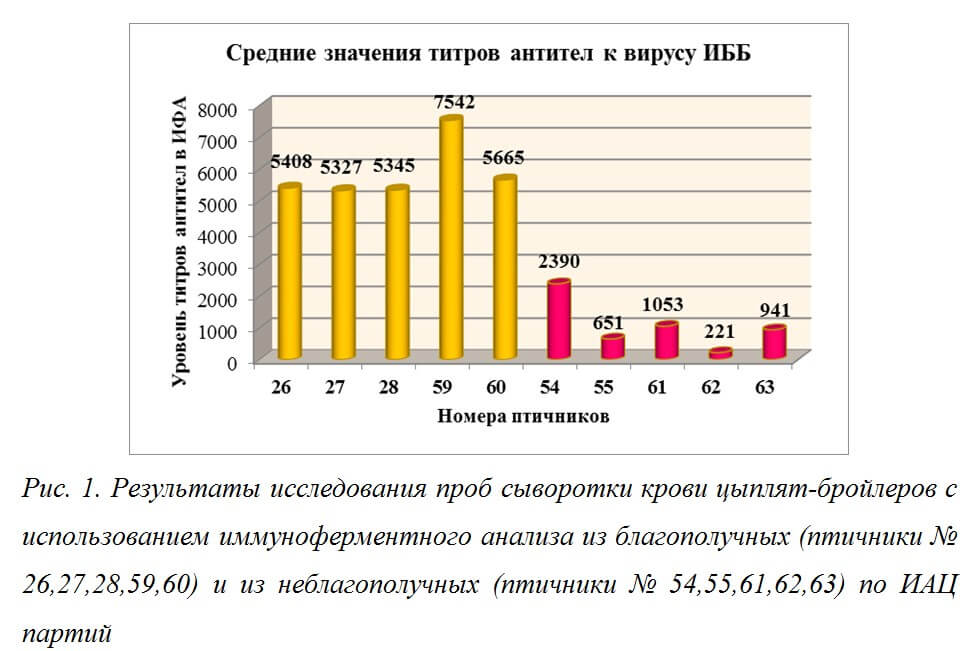
На рисунке 1 видно, что средние значения титров антител к вирусу ИББ у цыплят из птичников №№ 26, 27, 28, 59, 60 находятся в пределах допустимых значений титров антител к вирусу ИББ после применения живой вакцины, которые обеспечивает защиту поголовья птицы от полевого вируса. Средние значения титров антител у цыплят из птичников №№ 54, 55, 61, 62, 63 после применения живой вакцины низкие или соответствуют серонегативным значениям титров антител, что, соответственно, не может обеспечить защиту поголовья птицы от полевого вируса. Средние значения титров антител к вирусу ИББ в пробах сыворотки крови цыплят из птичников №№ 54, 55, 61, 62, 63 ниже средних значений титров антител в пробах сыворотки крови цыплят из птичников №№ 26, 27, 28, 59, 60 в среднем в 5,6 раза.
При оценке эффективности вакцинации необходимо учитывать также такой показатель как коэффициент вариации (CV), выраженный в процентах, который показывает однородность значений титров антител. Коэффициент вариации значений титров антител к вирусу ИББ в сыворотках крови цыплят из птичников №№ 54, 55, 61, 62, 63 выше, чем при исследовании проб сыворотки крови цыплят из птичников №№ 26, 27, 28, 59, 60 в среднем в 4,1 раза.
Аналогичные результаты были получены при исследовании проб сыворотки крови цыплят-бройлеров на наличие поствакцинальных антител к вирусу инфекционного бронхита кур и к вирусу ньюкаслской болезни.
G.F. De Boer et al. [73] установили, что в результате функциональных нарушений вирусом ИАЦ цитотоксических Т-лимфоцитов и естественных киллеров, возникают поражения, которые провоцируют поствакцинальные осложнения у суточных цыплят при иммунизации их против ньюкаслской болезни вакциной из штамма «Ла-Сота». У цыплят наблюдались такие признаки как угнетение, конъюнктивит, нарушение дыхания, смертность до 30%. Также отмечается снижение или отсутствие выработки ВНА при введении инактивированной вакцины против ИБК и ИББ [70].
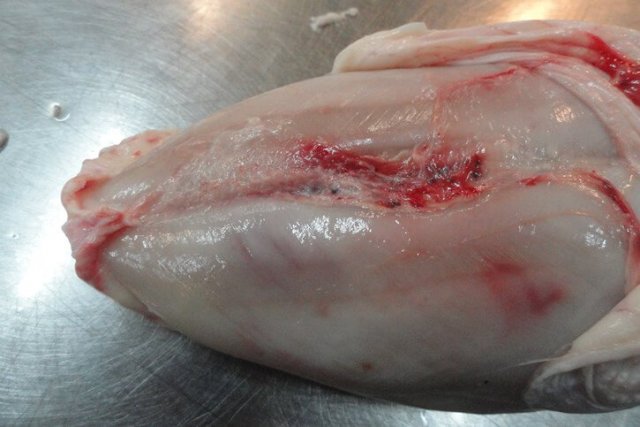
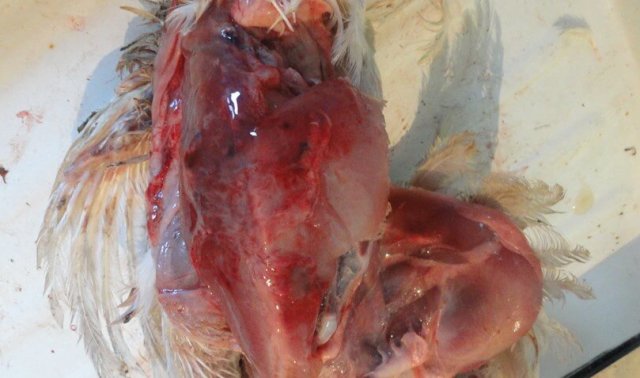
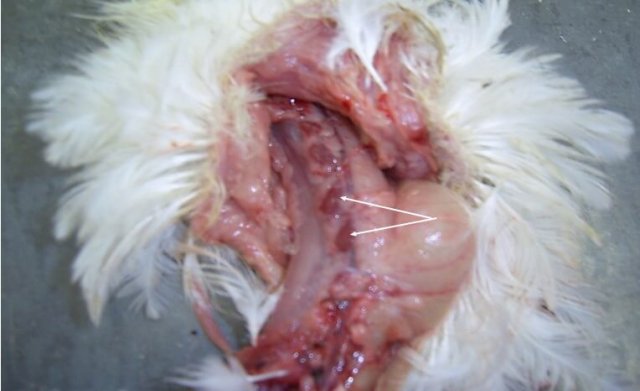
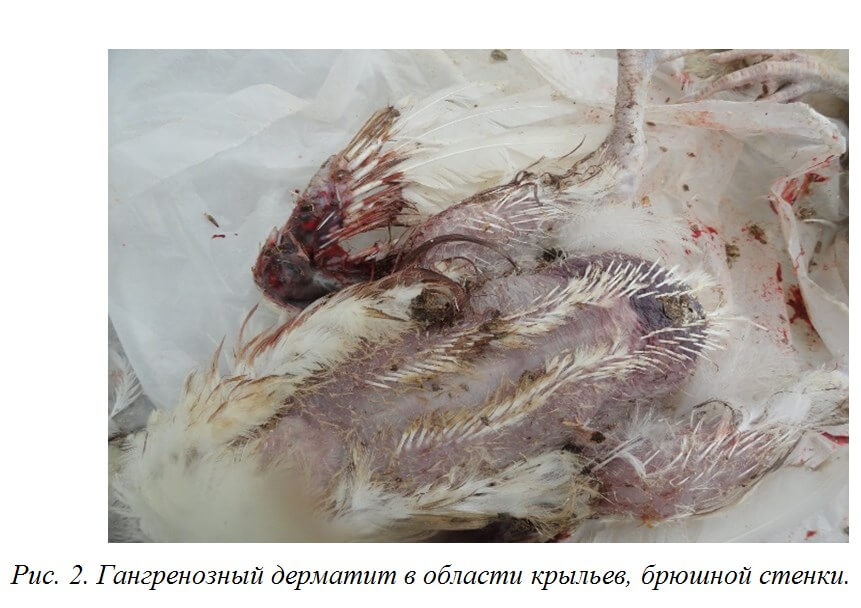
Инкубационный период при ИАЦ составляет 10-12 суток. Смертность может варьировать от 5 до 60% [3,19,25]. У цыплят болезнь проявляется депрессией, снижением аппетита и прироста живой массы, отставанием в развитии, анемией гребня, сережек, видимых слизистых оболочек [12]. В некоторых случаях наблюдается усиление пигментации, что проявляется желтизной клюва, гребня и сережек, нижних конечностей, кожных покровов [67]. Нередко выявляется гангренозный дерматит в области крыльев, копчиковой железы, спины, грудной клетки, брюшной стенки, бедер и голени [12] (рис. 2).
Иногда встречаются язвенно-некротические поражения на плюсне и подошве нижних конечностей [18]. Специфическим симптомом ИАЦ является анемия и снижение гематокрита на 6-27%. Возникновение на фоне ИАЦ вторичных инфекций сопровождается повышенной смертностью [25]. Заболеваемость и уровень смертности существенно возрастает при коинфекции ВАЦ с вирусами БМ, ИББ, вирусом ретикулоэндотелиоза [18,67], реовирусами, аденовирусами [19], вирусом НБ, с Staphylococcus aureus и бактериями рода Cryptosporidium [3], а также с Escherichia coli, Mycoplasma gallisepticum.
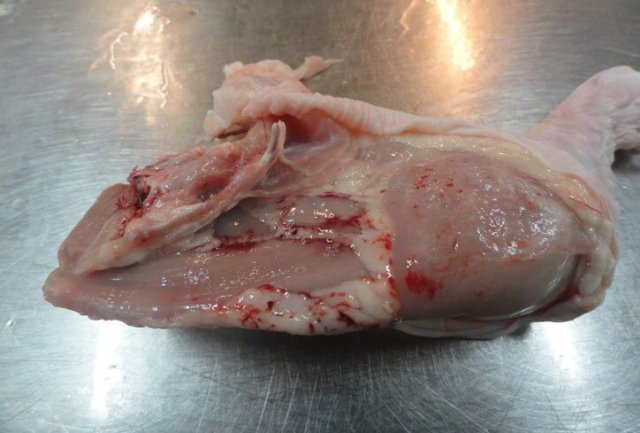
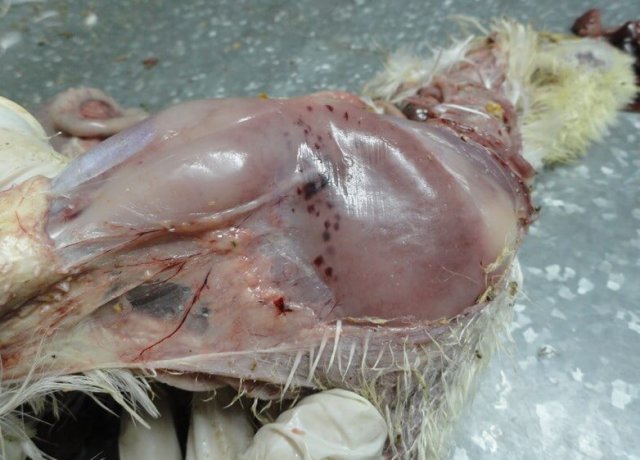
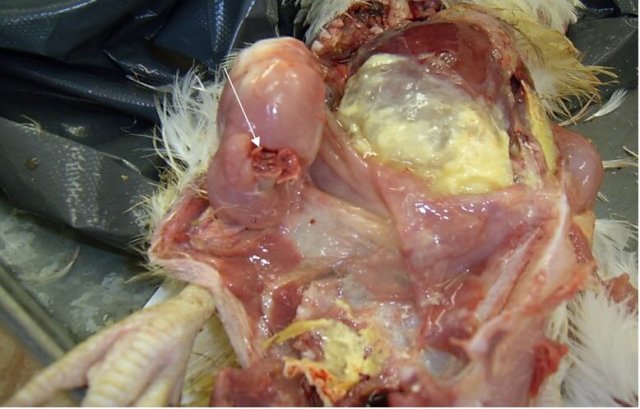
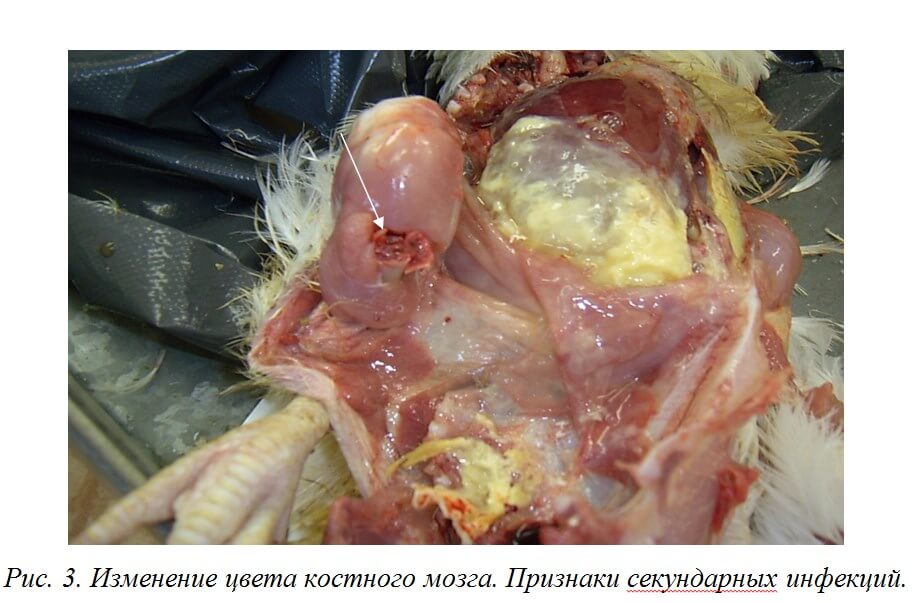
Характерными признаками ИАЦ являются атрофия и апоплазия костного мозга, атрофия и гипоплазия тимуса. Костный мозг бедренной кости имеет желтоватый, розоватый, иногда темно-красный цвет (рис. 3).
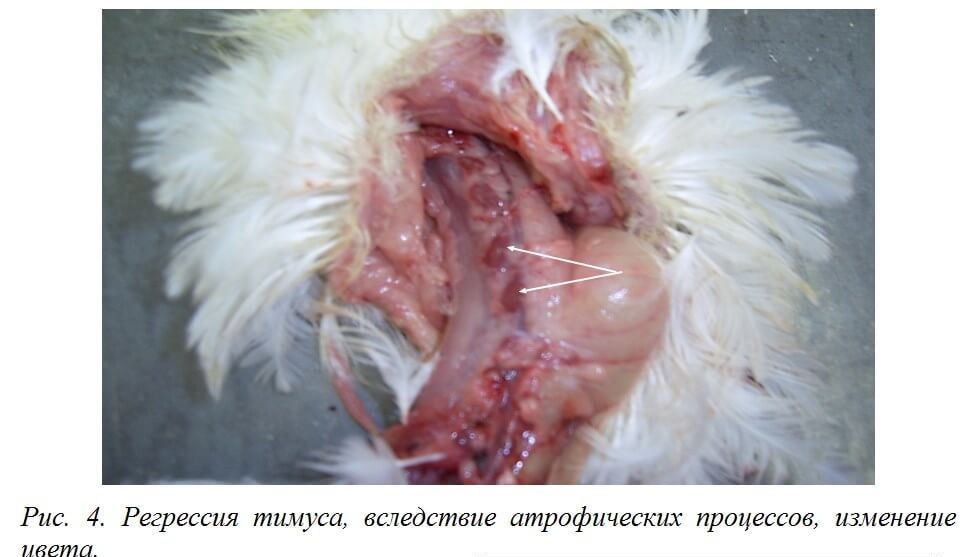
Атрофические процессы в тимусе приводят к регрессии органа. При этом тимус приобретает темно-красно-бурый цвет [25] (рис. 4).
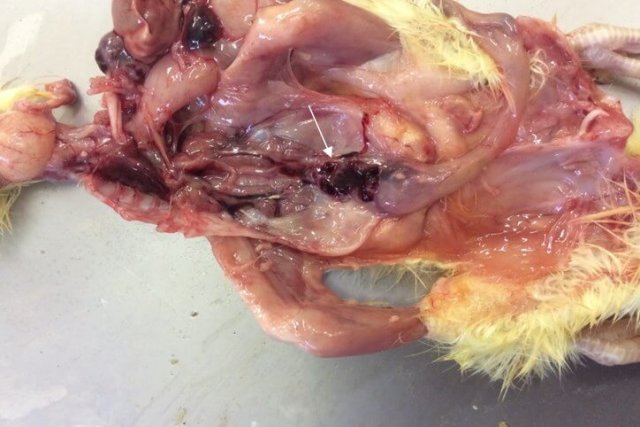
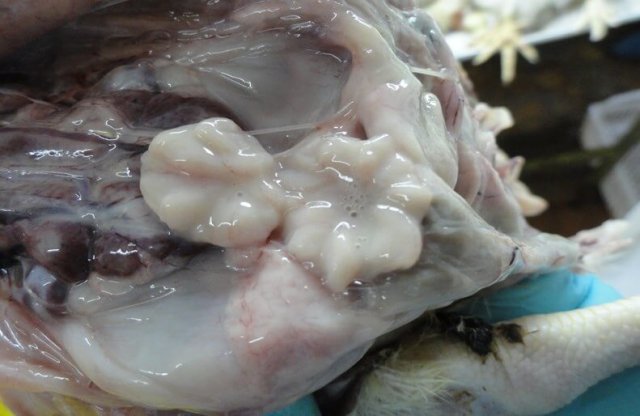
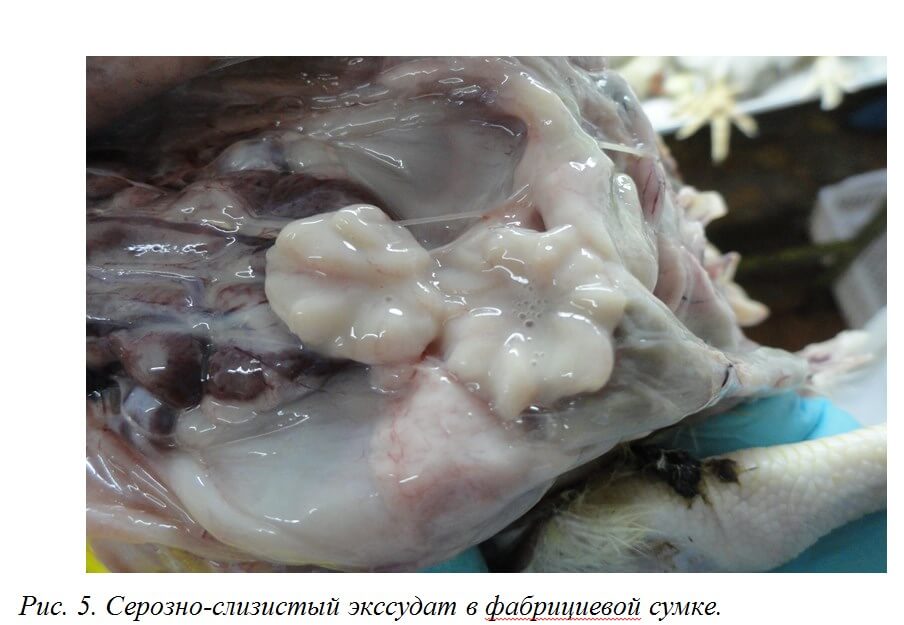
Поражения фабрициевой сумки представлены атрофией, наличием серозно-слизистого экссудата молочно-белого цвета, кровоизлияний [70] (рис. 5).
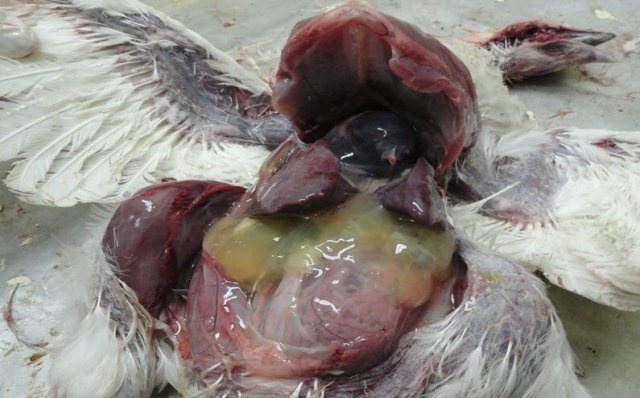
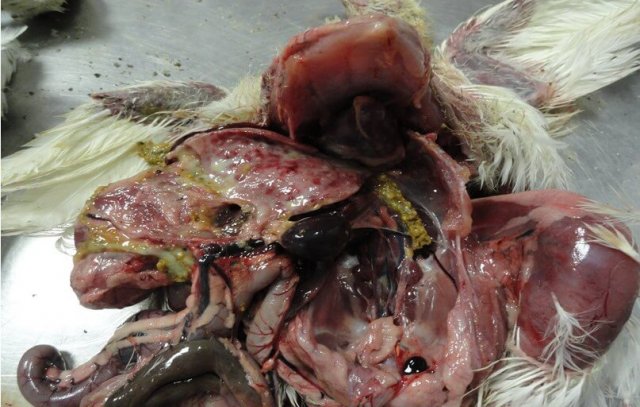
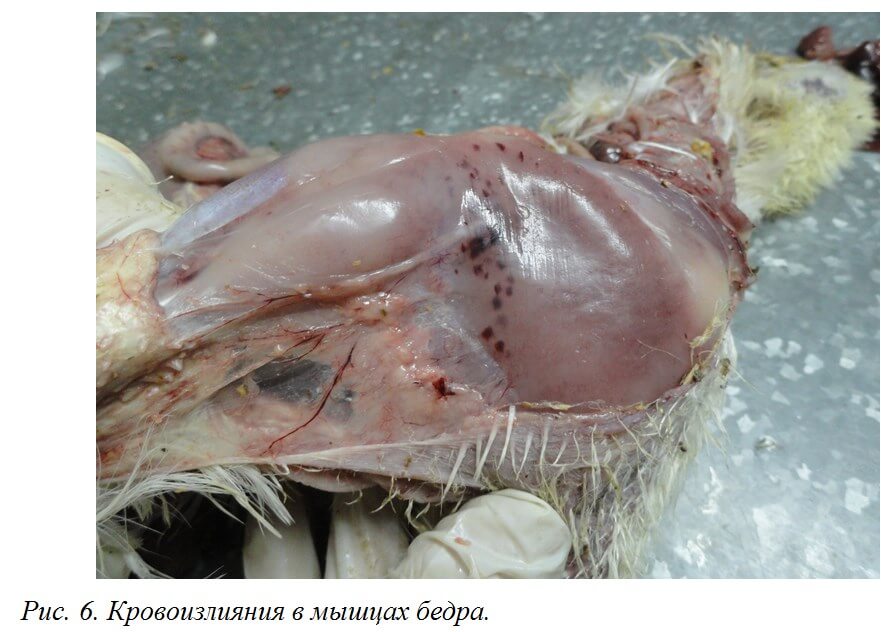
Выявляют внутримышечные и подкожные кровоизлияния, кровоизлияния на слизистой оболочке железистого желудка [50] (рис. 6, 7), на сердце, реже в других органах [19].
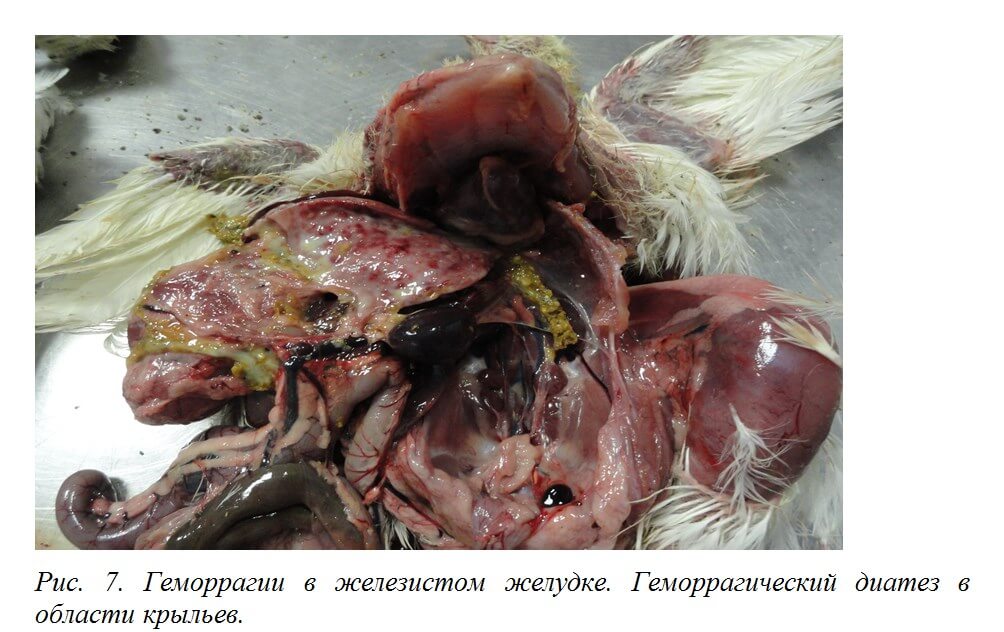
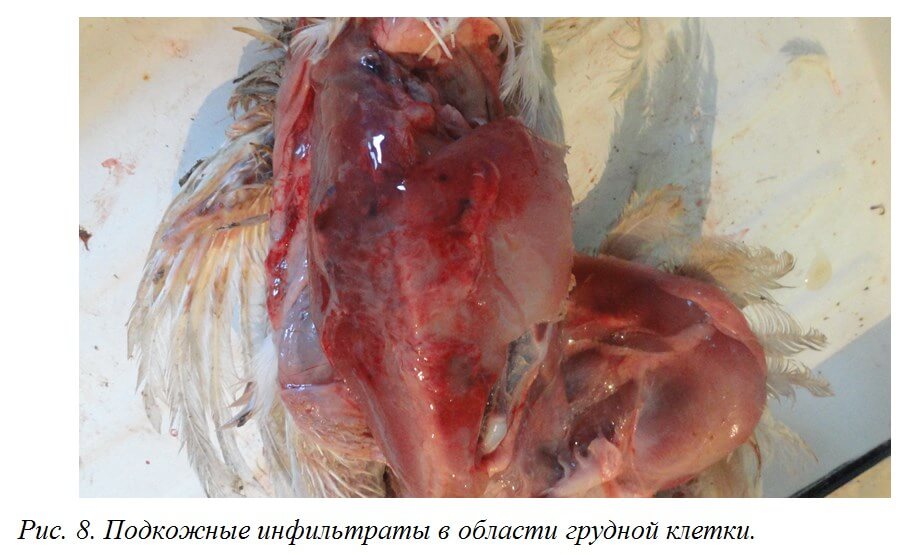
Инфицированные ВАЦ цыплята предрасположены к развитию пододерматитов [25]. Нередко выявляются подкожные темно-синие серозные инфильтраты в области крыльев («синее крыло»), которые могут распространяться на грудную клетку и брюшную стенку [50] (рис. 8.)
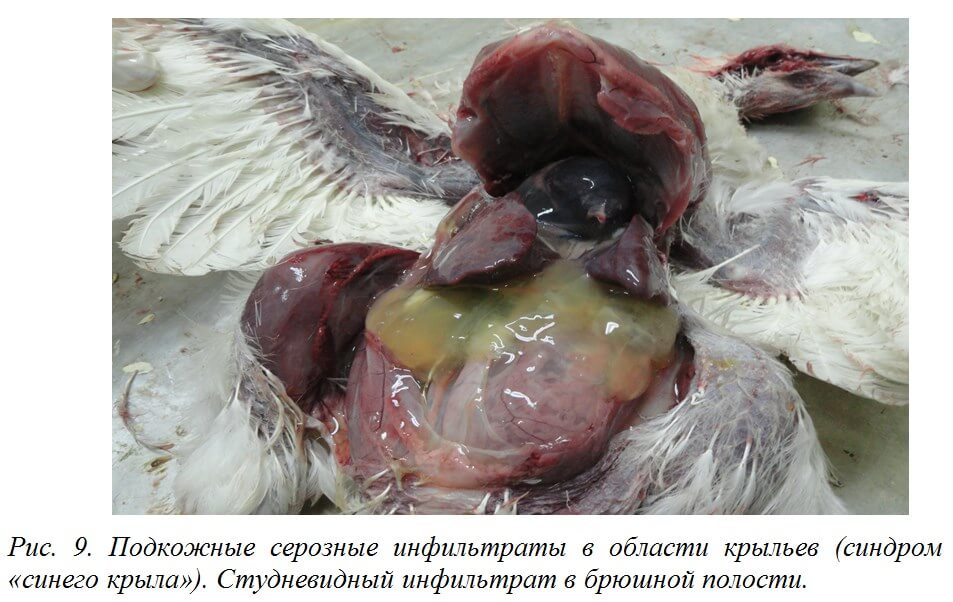
При ИАЦ встречаются инфильтраты в области брюшной стенки студневидной консистенции соломенно-желтого или буро-зеленоватого цвета [12].
Печень увеличена, светлая, с точечными кровоизлияниями и очагами некроза [19]. В брюшной полости нередко обнаруживают соломенно-желтый студневидный инфильтрат [12,70] (рис. 9).
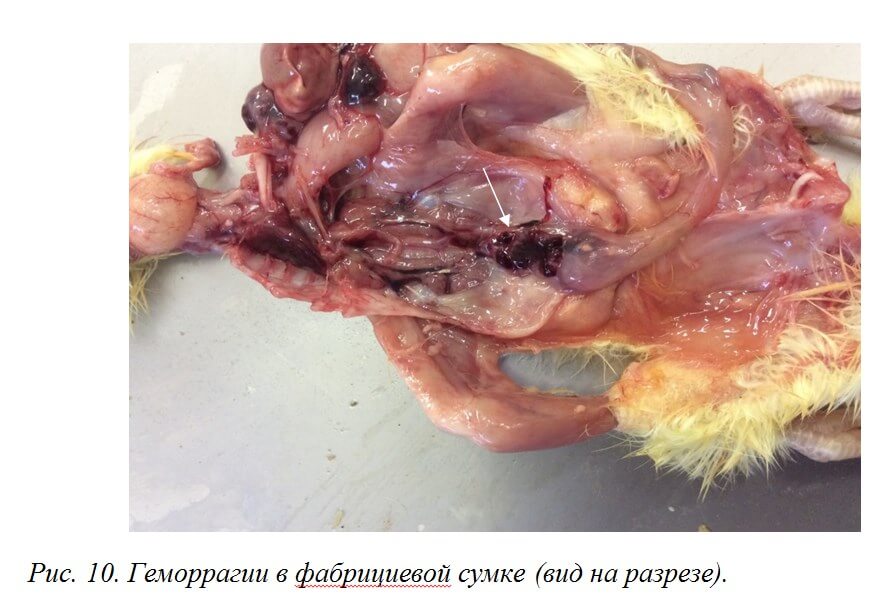
При патологоанатомическом вскрытии 5-7-суточных цыплят могут встречаться кровоизлияния в фабрициевой сумке, обусловленные трансовариальной передачей вируса ИАЦ (рис. 10).
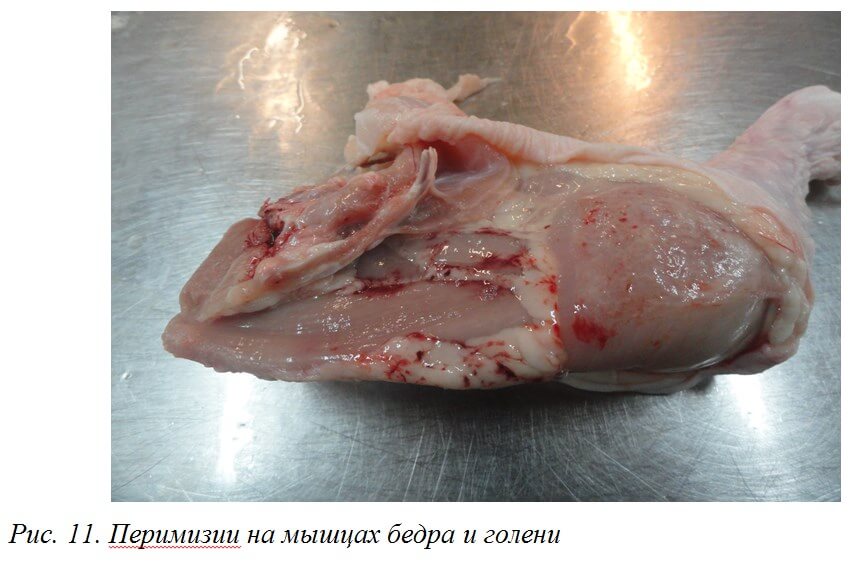
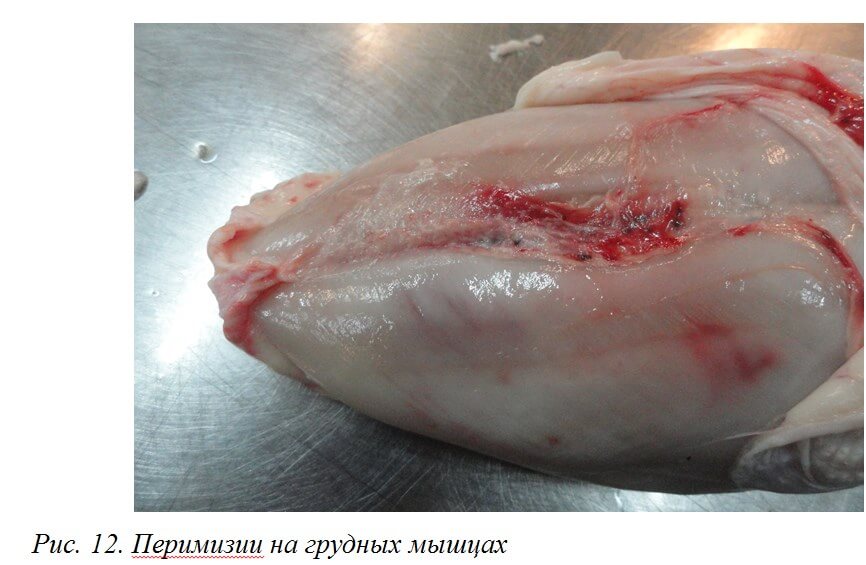
При ИАЦ снижается качество мясной продукции. При убое могут выявляться кровоизлияния, подкожные инфильтраты, геморрагические перимизии. Мясная продукция с такими дефектами, в зависимости от степени поражения, направляется в промпереработку или на утилизацию (рис. 11, 12).
Гистологические изменения характеризуются генерализованной лимфоидной атрофией. Наблюдается деструкция эритробластоидных клеток и истощение популяции кортикальных тимоцитов [25,74]. Количество эритроцитов, тромбоцитов и гранулоцитов снижается и отмечается их замена жировыми клетками или клетками пролиферирующей стромы. Отмечается атрофия и интенсивная лимфоидная гипоплазия тимуса и деплеция популяции Т и В-клеток [75]. В корковом слое тимуса отмечается истощение лимфоидных элементов, с последующим заполнением атрофированных долей ретикулярными и капиллярными клетками, а также капиллярной соединительной тканью [76]. Атрофия костного мозга является следствием апластической анемии, которая возникает в результате анемии, тромбоцитопении и панцитопении [67]. Поражения бурсы характеризуются атрофией лимфоидных ячеек, с очагами некроза, образованием складок на эпителии, отечной эпителиальной дегенерацией и пролиферацией ретикулярных клеток [25,38]. В печени, почках, легких, железистом желудке, двенадцатиперстной кишке и лимфоидных бляшках слепой кишки образование лимфоидных очагов приводит к истощению и уменьшению размеров клеток [38].
При ИАЦ кровь пораженных цыплят может иметь водянистую структуру, бледную плазму, более продолжительное время свертывания по сравнению с нормой. Низкий уровень гематокрита при ИАЦ обусловлен панцитопенией. Вследствие панцитопении значительно уменьшается количество эритроцитов, лейкоцитов и тромбоцитов [1,18].
ВАЦ вызывает специфические поражения лимфоидной ткани, вследствие чего нарушается функционирование иммунной системы [77,78]. При субклиническом течении ИАЦ, происходит угнетение иммунной функции, в результате селективного инфицирования клеток-предшественников первичных лимфоидных органов [79]. ВАЦ при репликации повреждает и разрушает лимфоциты кортикальной области тимуса, которые отвечают за выработку клеточного иммунитета, играющего важную роль в защите против ряда патогенов (вируса БМ, эймерий) [80].
Материнские антитела защищают цыплят от заражения ВАЦ до 7-21-суточного возраста. Активно иммунизированные куры являются источником ВАЦ и передают его трансовариально [40]. Коинфекция в возрасте 14-21 суток вирусами ИАЦ и ИББ провоцирует проявление у цыплят синдрома внезапной смерти и угнетает поствакцинальный иммунитет против герпесвируса индеек [81]. При коинфекции значительно уменьшаются популяции Т-клеток и макрофагов в тимусе и селезенке, по сравнению с моноинфекцией ИАЦ [50]. Угнетение индукции иммунного ответа является следствием повреждения ВАЦ гемопоэтической и лимфопоэтической систем с последующим генерализованным истощением лимфоцитов [17,25], а также в результате временного подавления функции макрофагов и снижения выработки цитокинов [37,59,60].
Быстро воспроизводимыми и достаточно информативными методами диагностики ИАЦ являются гематологическое и гистологическое исследования [50], иммуногистологический анализ тимуса [39]. Вирус ИАЦ можно выделить практически из всех органов. Для первичного выделения ВАЦ используют суточных СПФ-цыплят, которым внутримышечно или внутрибрюшинно инокулируют гомогенат печени, отобранной от больной или инфицированной птицы. На 14-21 сутки наблюдается падение гематокрита ниже 27% или атрофия костного мозга [25]. Для заражения можно использовать суспензии селезенки и лейкоцитов. Биопроба на чувствительных суточных цыплятах является наиболее специфичным и достаточным методом для постановки окончательного диагноза. Для биопробы могут быть использованы 4-5-суточные СПФ-куриные эмбрионы [50]. Для подтверждения диагноза также используют определение наличия антигенов вируса или вирусспецифической ДНК в тимусе и костном мозге посредством in situ гибридизации с использованием биотинизированного ДНК-зонда [25,48,82]. Наиболее чувствительным методом для выявления ВАЦ является полимеразно-цепная реакция (ПЦР) [15,17,25,48,83]. ПЦР позволяет выявлять возбудителя в культуре клеток через 3-4 дня после заражения патологическим материалом [84]. Вирусные частицы возбудителя ИАЦ также выявляют с помощью электронной микроскопии [85]. Для серологической диагностики ИАЦ используют реакцию нейтрализации, реакцию иммунофлуоресценции и иммуноферментный анализ (ИФА). Перспективным является метод ИФА на основе рекомбинантного антигена VP1 вируса ИАЦ [25].
ИАЦ дифференцируют от болезней, сопровождающихся развитием иммуносупрессии и анемии, таких как ИББ, гиповитаминоз В12, фолиеводефицитная и железодефицитная анемии, апластическая анемия при лимфоидном лейкозе, БМ, миелобластозе, эритробластозе, аденовирусной инфекции, остеопорозе, афлатоксикозе, отравлении сульфаниламидами [69].
Иммунитет при инфекционной анемии цыплят сложный. Вируснейтрализующие антитела защищают от клинического проявления болезни, но не обеспечивают эффективной защиты от инфицирования полевым вирусом [53].
Для специфической профилактики ИАЦ в мире разработаны живые, инактивированные и иммунокомплексные вакцины. В настоящее время доступные коммерческие живые вакцины получены из полевых штаммов, ослабленных в результате серийного пассажирования в культуре клеток или в куриных эмбрионах [86]. Тем не менее, вирусы в этих вакцинах обладают остаточной вирулентностью и способны передаваться вертикально или горизонтально, вызывая клинические признаки у молодых цыплят. Кроме этого, вакцинные штаммы вируса ИАЦ нестабильны и способны реверсировать к исходной вирулентности после передачи от цыпленка к цыпленку в полевых условиях [87,88]. В связи с этим производителями рекомендуется иммунизировать цыплят старше 6 недель и не позднее, чем за 4 недели до начала яйцекладки [25].
По данным G.F. McKenna et al. [89] некоторые аттенуированные штаммы вируса ИАЦ могут вызывать субклинические инфекции, которые не сопровождаются анемией или какими-либо существенными поражениями. У иммунизированных в раннем возрасте цыплят отмечается длительная персистенция вакцинного вируса ИАЦ в организме и его негативное воздействие на лимфоидную ткань, что потенциально может играть важную роль в развитии субклинических инфекций и влиять на уровень чувствительности организма птиц к другим патогенам. В настоящее время проводятся исследования по изучению влияния персистенции вакцинных штаммов ИАЦ на эффективность вакцинации против вирусных инфекций [87].
Среди живых вакцин наиболее известны: Nobilis® CAV P4 из штамма «26Р4» («Intervet International B.V.», Нидерланды), AviPro THYMOVAC из штамма «Cux-1», («Lohmann Animal Health GmbH & Co. KG», Германия), CIRCOMUNE® из штамма «Дел-Рос» («CEVA-BIOMUNE Veterinary Biologicals Company», США), GYROVAC из штамма «ОА1» («BIOVAC LTD», Израиль). Вакцинацию следует проводить в случае отсутствия антител к вирусу ИАЦ [90].
Имеются сведения об эффективности иммунокомплексных вакцин против ИАЦ. Вакцина в своем составе содержит вирус и специфические антитела. Иммунокомплексная вакцина вводится цыплятам в суточном возрасте или in ovo и работает по принципу симультанной иммунизации. Однако для создания коммерческих иммунокомплексных вакцин необходимы дополнительные исследования [91].
Разработаны инактивированные вакцины против ИАЦ [92,93], например, компанией «HIPRA» [18]. Необходимо, чтобы инактивированная вакцина содержала антиген вируса ИАЦ имеющий до инактивации титр вируса выше 107,5 TCID50 в дозе, предпочтительнее выше, чем 108,0 TCID50 или 109,0 TCID50. Необходимый титр можно получить с использованием различных методов концентрирования вируссодержащей жидкости, например, посредством ультрацентрифугирования [92].
Для решения проблемы неполной аттенуации вируса ИАЦ рядом исследователей были предприняты попытки разработать субъединичные вакцины [33]. Для получения рекомбинантного белка VP1 использовали E.coli [94,95], системы растений [96]. В Японии получена аттенуированная вакцина из штамма ВАЦ с заменой 394 пары нуклеотидов в белке VP1. В Нидерландах разработаны рекомбинантные субъединичные вакцины с использованием бакуловируса в качестве векторов генов VP1, VP2, VP3 [84]. Однако трудности, связанные с экспрессией гена VP1, до настоящего времени не позволяют разработать безопасную и эффективную вакцину против ВАЦ [32].
В последние годы ведутся разработки по конструированию ДНК-вакцин [45,96]. ДНК-вакцины являются безопасными, стабильными и способны индуцировать как гуморальный, так и клеточный иммунный ответ [97,98]. Вируснейтрализующие антитела против ВАЦ индуцируются при инокуляции ДНК-вакцинами на основе плазмид, содержащих в векторе белки VP1 и VP2 одновременно [97,99]. Однако, иммунизация ДНК-вакцинами требует больших затрат времени, так как их необходимо вводить цыпленку несколько раз, чтобы получить достаточный для защиты уровень титров антител [97,99,100,101,102].
Исследования A. Pages-Mante et al. [103] и X. Zhang et al. [100] показали, что трехкратное введение курам инактивированной вакцины с титром вируса 107,5 TCID50 или 7,9х1017 копий/мкл в дозе, вызывают индукцию материнских антител, имеющих достаточный уровень для защиты от вируса ИАЦ. Однако достичь высокого титра вируса для производства эффективной инактивированной вакцины является проблемой.
C.W. Canal et al. [104] и D.A. Roussan [105] было установлено, что титры антител у кур выше 1:5000 в ИФА защищают потомство от вируса ИАЦ в течение первых 4-х недель жизни.
Проводятся исследования по разработке вакцин с использованием различных стимуляторов иммуногенеза, например, клонированного куринного IL-12 [106], который стимулирует секрецию интерферона и репродукцию лимфоцитов в селезенке [107,108,109], а также повышает эффективность антигенов-кандидатов для производства вакцин [110,111]. Следовательно, IL-12 стимулирует иммунный ответ и является потенциальным адъювантом вакцин [108,112,113].
Так, в результате исследований T.-Y. Tseng et al. [33] было показано, что рекомбинантный белок VP1 совместно с куриным рекомбинантным IL-12 индуцировал высокоспецифичные антитела к вирусу ИАЦ. Для генерации VLP CAV использовали систему экспрессии бокаловируса, где экспрессируемый в этой системе IL-12 служил в качестве адъюванта для улучшения иммунного ответа у вакцинированных цыплят. Было установлено, что в сочетании с клонированным куриным IL-12 рекомбинантная вакцина против ИАЦ индуцировала системный иммунитет у вакцинированных цыплят и вызывала формирование антител в гораздо более высоких титрах, чем коммерческие вакцины.
Разработанная T.-Y. Tseng et al. [33] вакцина может обеспечить эффективную защиту, исключая недостатки живых аттенуированных вакцин против ИАЦ. Авторы исследований заявляют, что данная вакцина в будущем будет оптимизирована для крупномасштабного производства.
Помимо оптимизации вакцин с помощью рекомбинантных систем, адьювантов, таких как цитокины, эффективность вакцины можно повысить за счет повышения иммуногенности антигенов посредством стимуляции гуморального или клеточного иммунного ответа [114,115].
Вакцинация является вынужденной мерой, поэтому профилактика инфекционной анемии цыплят должна, прежде всего, опираться на качественное проведение комплекса ветеринарно-санитарных мероприятий, благополучие по болезни Марека, инфекционной бурсальной болезни и другим иммунодепрессивным инфекциям, на устранение прочих факторов (к примеру, антибиотиков, микотоксинов), негативно влияющих на функционирование иммунной системы.
----------
Для профилактики инфекционной анемии птиц рекомендуем использовать следующие вакцины
Nobilis® CAV P4 из штамма «26Р4» («Intervet International B.V.», Нидерланды), AviPro THYMOVAC из штамма «Cux-1», («Lohmann Animal Health GmbH & Co. KG», Германия)
Для симптоматического лечения и профилактики анемии рекомендуем: Витамин К протект
Витамин К протект улучшает процессы метаболизма и предотвращает дефицит витамина К и некоторых экзогенных аминокислот. Изначально Витамин К влияет на процесс свертываемости крови путем участия в синтезе факторов свертываемости. Витамин К также участвует в метаболизме коллагена в костях путем модификации протеина отвечающего за реадсорбцию ионов кальция в почках. Аминокислоты влияют на метаболизм протеинов в организме.
Применяется в птицеводстве для обогащения рациона домашней птицы витамин К и составляющие кармовую добавку аминокислоты.
Препарат Витамин К протект может быть использован при первичном или вторичном дефиците витамина К. в качестве вспомогательного препарата при заболеваниях вызывающих поражение печени, кишечный энтерит, для предотвращения геморрагического диатеза, при бактериальных, вирусных или паразитических заболеваниях, вызывающих поражение кровяных сосудов и после лечения антибиотиками и сульфаниламидами.
ЛИТЕРАТУРА
- Yuasa N., Taniguchi T., Yoshida I. Isolation and some characteristics of an agent inducing anemia in chicks. Avian Dis. 1979; 23: 366-385.
- Todd D. Circoviruses: Immunosuppressive threats to avian species: A review. Avian Pathol. 2000; 29: 373-394.
- Ganar K., Shah M., Kamdi B.P., kurkure N.V., et al. Molecular characterization of chicken anemia virus outbreaks in Nagpur province, India from 2012-2015. Microb. Pathogen. 2017; 102: 113-119.
- Breitbart M. Move genus Gyrovirus from the family Circiviridae to the family Anelloviridae. ICTV Taxonomy History for Chicken anemia virus, London UK, 2015.
- Bendinelli M., Pistello M., Maggi F., Fornai C., et al. Molecular properties, biology, and clinical implications of TT virus, a recently identified widespread infectious agent of humans. Clin. Microbiol. Rev. 2001; 14: 98-113.
- Hino S., Miyata H. Torque Teno Virus (TTV): current status. Rev. Med. Virol. 2007; 17: 45-57.
- Miyata H., Tsunoda H., Kazi A., Yamada A., et al. Identification of a novel GC-rich 113-nucleotide region to complete the circular, singl-stranded DNA genome of TT virus, the first human circovirus. J. Virol. 1999; 73: 3582-3586
- Prasetyo A.A., Kamahora T., Kuroishi A., Murakami K., et al. Replication of chicken anemia virus (CAV) requires apoptin and is complemented by VP3 of human torque teno virus (TTV). Virol. 2009; 385: 85-92.
- Schat K.A. Chicken anemia virus. In: TT viruses. The still elusive human pathogens. Eds. E.-M. de Villiers, H. zur Haunsen. Springer-Verlang Berlin Heidelberg, 2009, pp. 151-184. ISBN 978-3-540-70971-8. DOI: 10.1007/978-3-540-70972-5.
- ICTVdB (2006).00.016.0.02.001. Chicken anemia virus.
- Дмитриева М.Е., Джавадов Э.Д., Людькова Е.С. Инфекционная анемия цыплят. Диагностика и профилактика. СПб., 2011 [Dmitrieva M.E., Dzhavadov E.D., Lyud'kova E.S. Infektsionnaya anemiya tsyplyat. Diagnostika i profilaktika. SPb., 2011 (In Russ).
- Самуйленко А.Я., Соловьев Б.В., Непоклонов Е.А., Воронин Е.С. и др. Инфекционная патология животных. Т. 1. М., 2006 [Samuilenko A.YA., Solov'yev B.V., Nepoklonov E.A., Voronin E.S. i dr. Infektsionnaya patologiya zhivotnykh. T. 1. M., 2006 (In Russ).]
- Pringle C.R. Virus taxonomy at the ΧIth International Congress of Virology, Sydney, Australia. Arch. Virol., 1999, 144: 2065-2070.
- Davidson I., Raibshtein I., AlTori A., Elrom K. The consequence of a singl nucleotide substitution on the molecular diagnosis of the chicken anemia virus. Israel J. Vet. Med. 2015; 70(2): 30-32.
- Natesan S., Rftaria J.M., Dhama K., Bhardwaj N., et al. Anti-neoplastic effect of chicken Anemia virus VP3 protein (apoptin) in Rous sarcoma virus-induced tumours in chicken. J. Gen. Virol. 2006; 87: 2933-2940.
- Hegazy A.M., Abdallah F.M., Abd-El Samie L.R., Nazim A.A. Incidence of chicken anemia virus in Sharkia governorate chicken flocks. Assiut. Vet. Med. J. Vol. 2014; 60 (142): 75-82.
- Алиев А.С., Зимин К.В., Серова Н.Ю. Инфекционная анемия цыплят. БИО. 2011; 1/2 (124/125): 6-12 [Aliev A.S., Zimin K.V., Serova N.YU. Infektsionnaya anemiya tsyplyat. BIO. 2011; 1/2 (124/125): 6-12 (In Russ).]
- Бакулин В.А. Болезни птиц. СПб., 2006 [Bakulin V.A. Bolezni ptits. SPb., 2006 (In Russ).]
- Ducatez M.F., Owoade A.A., Abiolaand J.O., Muller C.P. Molecular epidemiology of chicken anemia virus in Nigeria. Arch. Virol. 2006; 151: 97-111.
- Ducatez M.F., Chen H., Guan Y., Muller C.P. Molecular epidemiology of chicken anemia virus (CAV) in South Eastern Chinese live bird markets. Avian Dis. 2008; 52: 68-73.
- Noteborn M.H., Todd D., Verschueren C.A., de Gauw H.W., et al. A single chicken anemia virus protein induces apoptosis. J. Virol. 1994; 68: 346-351.
- Zhuang S.M., Landegent J.E., Verschueren C.A.J., Falkenburg J.H.F., et al. Apoptin, a protein encoded by chicken anemia virus, induces cell death in various human hematologic malignant cells in vitro. Leukemia. 1995; 9: 118-120.
- Zhuang S.M., Shvarts A., van Ormondt H., Jochemsen A.G., et al. Apoptin, a protein encoded by chicken anemia virus, induced p53-independent apoptosis in human osteosarcoma cells. Cancer Res. 1995; 55: 486-489.
- Schat K.A., van Santen V.L. Chicken infectious anemia. In: Disease of Poultry, 13thedition / D.E. Swayne, J.R. Glisson, L.R. McDougald, L.K. Nolan, D.L. Suarez, V. Nair (ads.). John Wiley&Sons, Inc., 2013: 248-264.
- Natesan S., Kataria J.M., Dhama K., Rahul S., Baradhwaj N. Biological and molecular characterization of chicken anemia virus isolates of Indian origin. Virus Res. 2006; 118: 78-86.
- He C.Q., Ding N.Z., Fan W., Wu Y.H., et al. Identification of chicken anemia virus putative intergenotype recombinants. Virology. 2007; 366: 1-7.
- Basaraddi M.S., Dhama K., Wani M.Y., Sawant P.M., et al. Down regulation in cytokines profiles and immunopathological changes in chicks infected with chicken infectious anaemia virus. African J. Microbiol. Res. 2013; 7: 2464-2474.
- Wani M.Y., Dhama K., Barathidasan R., Gowthaman V., et al. Molecular detection and epidemiology of chicken infectious anaemia virus in India. South Asian J. Exp. Biol. 2013; 3(4): 145-151.
- Peters M.A., Jackson D.C., Crabb B.S., Browning G.F. Chicken anemia virus VP2 is a novel dual specificity protein phosphatase. J. Biol. Chemistry. 2002; 277: 39566-39573.
- Peters M.A., Crabb B.S., Washington E.A., Browning G.F. Site-directed mutagenesis of the VP2 gene of chicken anemia virus affects virus replication cytopathology and host-cell MHC class I expression. J. Gen. Virol. 2006; 87: 823-831.
- Sandhya N., SaiGopal D.V.R. Chicken anemia virus an economically important poultry virus. Int. J. Rec. Sci. Res. 2019; 10: 32065-32070.
- Tseng T.-Y., Liu Y.-C., Hsu Y.-C., Chang P.-C. et al. Preparation of chicken anemia virus (CAV) virus-like particles and chicken interleukin-12 for vaccine development using a Baculovirus expression system. Pathogens. 2019; 8: 262-274. DOI: 10.3390/pathogen
Сопровождения предприятий свиноводства и птицеводства
Мы используем ветеринарные препараты нового поколения
На вашу птицефабрику или свиноводческий комплекс
Все товары и услуги сертифицированы