Грипп птиц в Мире и России: анализ текущей ситуации и пути выхода.
Обновленная и более полная версия статьи ЗДЕСЬ
11 марта 2019 года Всемирная организация здравоохранения (ВОЗ) выпустила Глобальную стратегию по гриппу на 2019–2030 гг., призванную защищать жителей всех стран от угрозы гриппа. Цель стратегии заключается в предупреждении сезонного гриппа, противодействии передаче гриппа от животных человеку и подготовке к следующей пандемии гриппа.
«Угроза пандемического гриппа присутствует постоянно, — отметил Генеральный директор ВОЗ д-р Тедрос Адханом Гебрейесус. — Всегда существует реальный риск передачи нового вируса гриппа от животных человеку и, возможно, возникновения пандемии. Вопрос не в том, случится ли у нас еще одна пандемия, а в том, когда она произойдет. Мы должны сохранять бдительность и пребывать в состоянии готовности: ущерб от крупной вспышки гриппа значительно превзойдет цену его профилактики».
Грипп по-прежнему является одной из самых серьезных проблем мирового общественного здравоохранения. Согласно оценкам, ежегодно на планете происходит 1 миллиард случаев заболевания гриппом, из которых от 3 до 5 миллионов представляют собой тяжелые случаи, в результате которых от связанных с гриппом респираторных осложнений умирают от 290 000 до 650 000 человек. ВОЗ рекомендует ежегодно проходить вакцинацию от гриппа, поскольку это самый действенный способ уберечься от болезни.
Между тем объемы производства мяса птицы продолжают расти во всем мире с соответствующим увеличением плотности поголовья и концентрации производственных объектов. Потепление климата вносит новые переменные в схемы передачи возбудителя птичьего гриппа и взаимодействия домашних птиц с их дикими мигрирующими сородичами.
За последние пять лет произошло несколько значительных эпизоотий птичьего гриппа, продолжается эволюция и диверсификация вирусного ландшафта. Высокопатогенный птичий грипп (ВПГ) H5Nx распространился на страны по всему миру и вызвал крупные вспышки в Азии, Европе и Соединенных Штатах. H7N9 стал причиной вспышек в Китае, причем последняя волна включала заметный рост числа инфекций среди людей и эволюцию фенотипа высокой патогенности. Для отслеживания новых и развивающихся штаммов гриппа в популяциях диких и домашних птиц постоянно требуются исследования и эпиднадзор. В сочетании с молекулярными и вирусологическими такие исследования могут позволить идентифицировать вирусные подтипы, вызывающие особую озабоченность (повышенная вирулентность и/или межвидовая передача), и помочь сосредоточить ограниченные ресурсы там, где они, вероятно, принесут наибольшую пользу.
Новая область исследований охватывает влияние антропогенных и климатических факторов на эволюцию и распространение птичьего гриппа. Знания о воздействии антропогенных факторов (например, развитие рынка живой птицы, межхозяйственное перемещение и глобальная торговля) остаются ограниченными о моделях передачи птичьего гриппа и способах, с помощью которых изменение климата может изменить поведение вируса и эпидемиологию. Также необходимы дополнительные исследования диких резервуаров птичьего гриппа и путей, по которым они могут взаимодействовать с домашними птицами.
Межвидовая передача (особенно зоонозная передача) является областью, вызывающей серьезную озабоченность, и прогнозирование зоонозного риска штаммов птичьего гриппа остается сложным. Новые события – например, недавно зарегистрированные случаи заболевания людей H10N3 в Китае и H5N8 в России - иллюстрируют важность увязки эпидемиологических исследований с базами данных молекулярной вирусологии для повышения нашей способности прогнозировать и контролировать потенциально зоонозные подтипы гриппа.
Таким образом, грипп представляет реальную угрозу в равной степени безопасности населения, стабильности и устойчивому развитию птицеводческой отрасли всего мира. Справиться с растущей угрозой могут лишь объединенные усилия медицинской и ветеринарной науки.
===========================================
Эдуард Маилян, к.вет.н., Независимый эксперт по птицеводству
Пока человечество пребывало в ожидании очередной пандемии сезонного гриппа, злополучная вспышка коронавирусной инфекции в китайском Ухане в декабре 2019 года внесла в миропорядок ощутимые коррективы.
В то время как медицина в течение двух лет вела отчаянную борьбу с новоявленной инфекцией, в птицеводстве прокладывали себе дорогу высоко- и низкопатогенные* подтипы вируса гриппа птиц (ВПГ/НПГ).
Грипп птиц является сегодня основной темой, тревожащей птицеводов всего мира. Эпизоотия нынешнего сезона, при которой на конец ноября было зарегистрировано свыше 3700 случаев ВПГ и потеряно около 22,5 млн поголовья в 28 странах Европы, по-видимому, является одной из крупнейших и самых разрушительных за всю историю птицеводства (Рис. 1).
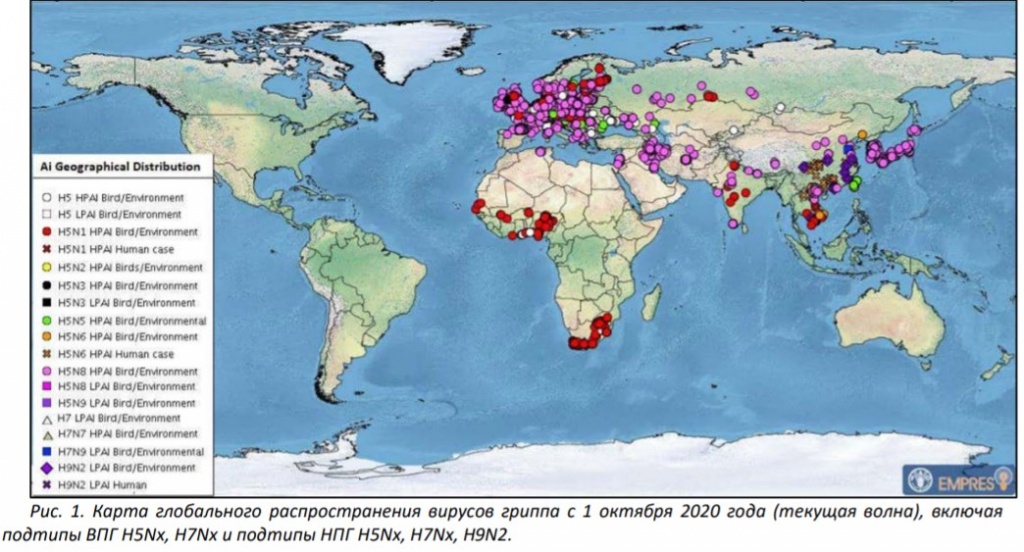
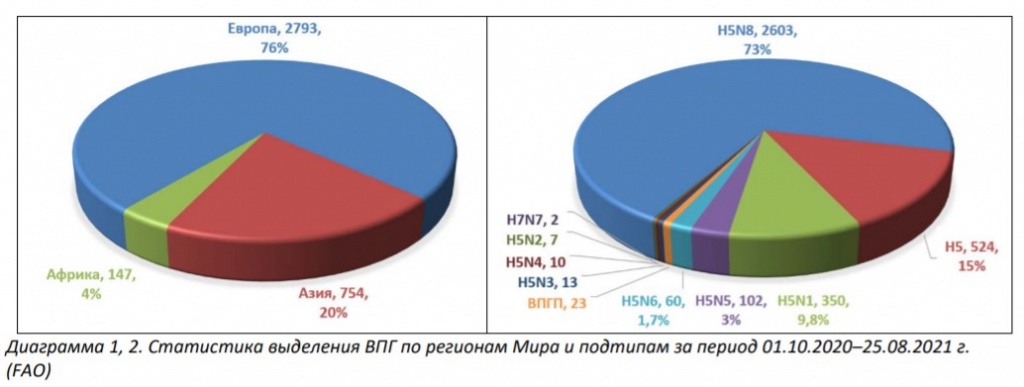
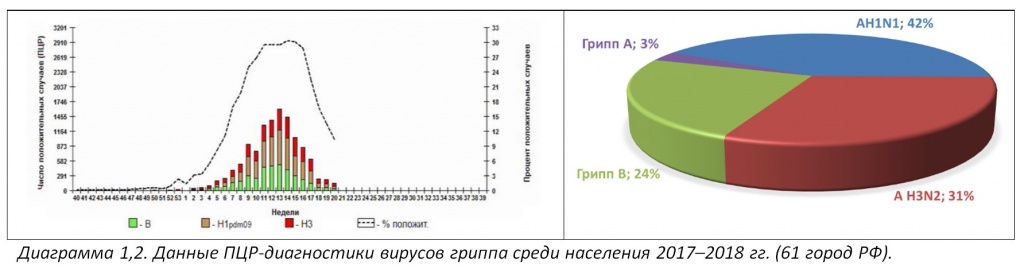
По данным FAO основной удар ВПГ в текущем сезоне пришелся на Европу (76%), Азию (20%) и, в меньшей степени – Африку (4%) (Диаграмма 1).
Среди диких и домашних птиц этих регионов обнаруживают преимущественно нотифицируемые высокопатогенные (ВПГ) подтипы гриппа А Н5N8 (73%) и Н5N1 (10%), причем последний начал появляться лишь к концу второй волны. Значительно реже выделяют подтипы H5N5 (3%) и H5N6 (1,7%) (Диаграмма 2).
*Термины «низко-» и «высокопатогенный» не являются корректными с точки зрения академической науки и классической терминологии. Правильнее называть их «низко-» и «высоковирулентный», так как именно вирулентность – есть степень патогенности. Однако в статье мы будем использовать привычную терминологию, чтобы не вносить еще большую путаницу.
Судя по развитию ситуации, происходящее уже можно классифицировать как полноценную панзоотию.
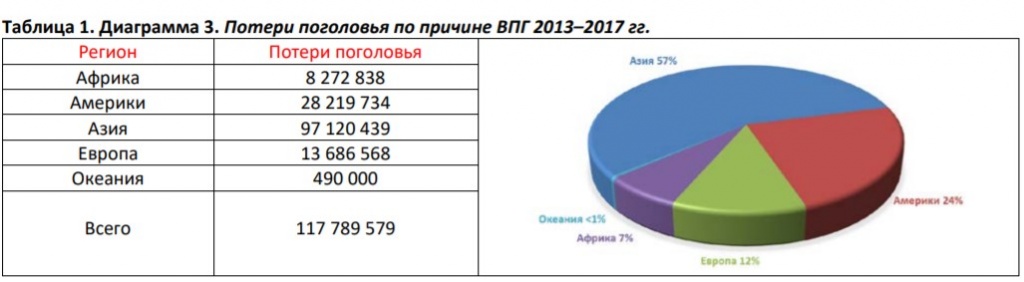
Напомним, что за период 2013–2017 гг вспышки ВПГ в Мире в общей сложности привели к гибели порядка 120 млн птиц.
За 2021 год на территории Российской Федерации было зарегистрировано 18 случаев ВПГ, включая диких и домашних птиц, однако намного более напряженная обстановка сложилась с НПГ H9N2.
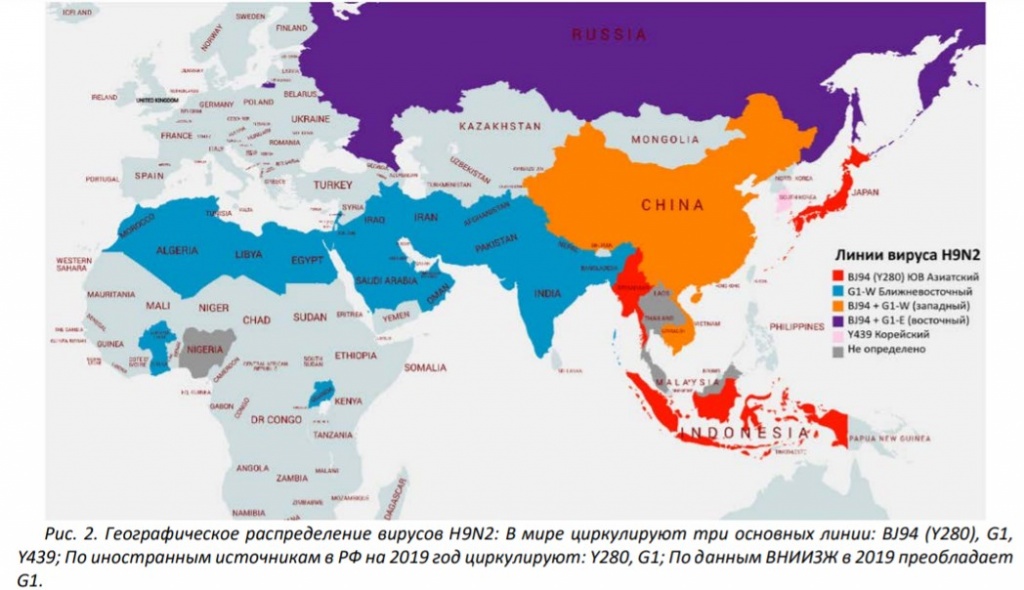
Историческая справка: вирусы H9N2 были впервые выделены у индеек в американском штате Висконсин в 1966 году. В последующие десятилетия вирус иногда выявлялся во время спорадических вспышек среди домашней птицы в северных штатах США, а также у диких птиц и домашних уток по всей Евразии. В начале 1990-х годов вирус был впервые выделен у кур в Китае, а в последующие десятилетия вирусы, связанные с этим китайским генотипом, стали эндемичными для птицеводства на большей части Юго-Восточной Азии, Ближнего Востока и Северной и Западной Африки. Вирусы H9N2, как правило, гиперэндемичны в затронутых странах и в последние годы были обнаруживаются у домашней птицы во многих новых регионах: Бангладеш, Пакистан, Индия, Афганистан, Непал, Египет, Иран, Израиль, Саудовская Аравия, ОАЭ, Ирак, Иордания, Кувейт, Ливан и Оман
Однако глобальный эпиднадзор за H9N2 затруднен, так как вирусы НПГ не подлежат обязательной нотификации и редко поражают человека. Во многих регионах с ограниченными ресурсами эпиднадзор проводится эпизодически или вообще не проводится.
Вирусы H9N2 неоднократно изолировались от нечеловеческих млекопитающих, таких как свиньи и норки — эти хозяева представляют особую угрозу для появления новых пандемических вирусов, поскольку они очень восприимчивы как к вирусам человеческого, так и к птичьему гриппу и могут стимулировать генерацию новых реассортантов.
С 2012 до середины 2018 года в РФ было официально зарегистрировано только 3 случая заболевания НГП H9N2 - в ДФО (Амурская область и Приморский край). Однако, с июня 2018 по декабрь 2020 года было зарегистрировано 7 случаев заболевания H9N2: Приморье (2), Татарстан (1), Пермский край (1), Челябинская область (2), Волгоградская область (1). А в марте 2021 года, по данным независимых лабораторий, сероконверсия антител к возбудителю НГП H9N2 регистрировалась как минимум на половине птицеводческих предприятий яичного, племенного и бройлерного направлений.
Учитывая скорость распространения вируса, можно предположить, что до конца 2021 года он успеет побывать на поголовье большинства отечественных птицефабрик. При этом НПГ H9N2 в условиях интенсивного промышленного птицеводства нередко ведет себя как высоколетальный возбудитель, способный в сочетании с другими респираторными инфекциями, вызывать гибель до 80% поголовья. Данный факт также подтверждают специалисты из разных стран.
Поначалу отдельным эпизодам выделения на птицефабриках НПГ H9N2 не придали большого значения в связи с тем, что случаи его обнаружения не подлежат обязательной нотификации, и поэтому реальные масштабы эпизоотии прояснились значительно позже.
Не исключено, что ситуацию с НПГ Н9N2 осложнила предшествующая ей циркуляция велогенного, нейротропного VII генотипа болезни Ньюкасла, оставшаяся без должного внимания весной 2020 года из-за коронавирусной пандемии. В связи с тем, что от данного генотипа возбудителя БН на российском рынке нет специфической вакцины, предприятиям приходилось практически «заливать» поголовье живыми вакцинами штамма Ла Сота с целью вытеснения полевого вируса. Данной мерой не всегда удавалось быстро решить проблему БН, а вот создать огромный респираторный стресс на поголовье за счет использования жесткой вакцины, и тем самым спровоцировать осложнения от НПГ – вполне вероятный сценарий.
В связи с тем, что оба вируса второй год подряд регистрируют на большом количестве предприятий, благополучие отечественной птицеводческой отрасли оказалось в зоне повышенного риска. В сложившейся эпизоотической обстановке приходится говорить не столько о сокращении экспортного потенциала страны, как об угрозе ее продовольственной и биологической безопасности.
Не следует забывать и о том, что в условиях сочетанных респираторных инфекций как правило наблюдается всплеск вторичных бактериальных болезней, провоцирующих массовое применение антибактериальных средств широкого спектра действия. Это в свою очередь приводит к ускоренному развитию микробной антибиотикорезистености (МАР). Актуальность данной темы сегодня находится на пике, особенно в рамках глобальной программы борьбы с МАР, нацеленной на сокращение количества применяемых в животноводстве антибиотиков, а также на фоне утвержденной Российским правительством «Стратегии предупреждения распространения МАР в РФ на период до 2030 года» и Федерального закона «О биологической безопасности в Российской Федерации» от 30.12.2020 г.
Перед отечественными индейководами, и отраслью в целом, стоят амбициозные задачи по наращиванию объемов производства, повышению качества и безопасности продукции для потребителей, укреплению экспортного потенциала, однако сложившаяся эпизоотическая обстановка на российских птицефабриках вызывает серьезную озабоченность и ставит под сомнение достижение этих целей.
Причины сложившейся ситуации
Первая причина возникновения сложившейся ситуации заключалась в устаревшей законодательной базе. Согласно действующих до недавнего времени «Ветеринарных правилах по борьбе с гриппом птиц» от 27 марта 2006 года в случае установления и подтверждения факта циркуляции на поголовье низкопатогенных вирусов подтипов H4, Н6, Н9, или иных (кроме Н5 и Н7), не требующих обязательной нотификации, вне зависимости от клинических проявлений на поголовье, было предписано проводить мероприятия по ликвидации гриппа птиц со всеми вытекающими ограничительными мероприятиями (карантин, уничтожение поголовья и ограничения использования продукции). Однако по факту данные предписания не исполнялись, предполагая, что ущерб от возбудителя НПГ будет незначительным.
Вынужденная или профилактическая вакцинации были предусмотрены только в пределах угрожаемой зоны на усмотрение Главного государственного ветеринарного инспектора Российской Федерации. Вакцинация была одобрена не везде. Но, к сожалению, решения о профилактической вакцинации птицы от НПГ принимались избирательно!
Птицеводы положительно приняли новые ветеринарные правила по гриппу птиц от 24 марта 2021 года, охватывающие лишь стратегию борьбы с ВПГ, информация по НПГ в них отсутствовала. Не обошлось и без недоработок (см. ниже).
Чуть позже Министерством сельского хозяйства были разработаны и предложены к обсуждению «Методические рекомендации по контролю НПГ в промышленном птицеводстве». Они подробно описывают мероприятия и стратегию оздоровления хозяйств от НПГ на выбор: с вакцинацией или без нее - на усмотрение государственной ветеринарной службы. Однако на их рассмотрение и утверждение уйдет еще как минимум год!
К сожалению, на фоне образовавшегося законодательного вакуума ужесточение санитарных требований без обязательной депопуляции («stamping-out») поголовья не может выступать в качестве единственного механизма контроля НПГ на крупных птицеводческих предприятиях со сложной, тесно переплетенной инфраструктурой.
Технология «stamping-out» при больших масштабах распространения вируса гриппа также теряет актуальность, поскольку может привести к неприемлемым как для отдельных предприятий, так и для всей отрасли в целом, экономическим потерям, невосполнимым в краткосрочной перспективе.
Второй причиной, не позволяющей осуществлять своевременную, качественную профилактику гриппа птиц является инертность отечественной биологической промышленности, не уделяющей должного внимания актуализации вакцин против возбудителей, циркулирующих в птицеводческом секторе, особенно – в индейководстве. Так, к примеру, в портфолио российских биофабрик до сих пор нет вакцины от геморрагического энтерита индеек.
В свете сложной эпизоотической ситуации в Европе активно обсуждается концепция вакцинации от ВПГ, однако она встречает большое сопротивление, основанное на аргументах о том, что она не соответствует стратегиям контроля МЭБ и ЕС, негативно влияет на экспортные торговые соглашения и потенциально маскирует симптомы заболевания, тем самым устраняя наиболее значимый сигнал раннего предупреждения для ВПГ – резкий всплеск смертности.
В свою очередь препятствия на пути принятия на законодательном уровне решения о профилактической вакцинации птиц от НПГ в большинстве стран, включая Россию, сводятся к трем основным причинам:
- Невозможность мониторинга циркуляции полевых вирусов на вакцинированном поголовье.
- Вероятность реассортации циркулирующих вирусов в новые пандемические подтипы.
- Ограничения экспортного потенциала птицеводческой продукции.
Однако эти опасения не всегда обоснованы, так как решения существуют:
- Мониторинг полевых вирусов возможно осуществлять методом «DIVA» - дифференциация инфицированных животных от вакцинированных путем помещения в стадо невакцинированных животных-сателлитов, или с применением инактивированной вакцины с гомологичным полевому гемагглютинином (Н), но гетерологичной нейраминидазой (N). Гомологичный подтип Н обеспечивает защиту, в то время как можно дифференцировать вакцинированных от инфицированных птиц на основе серологического ответа на подтип N с помощью непрямого иммунофлуоресцентного теста. Вакцинированные птицы должны дать положительный результат только на N, используемую в вакцине, положительная реакция на N преобладающего инфекционного вируса будет указывать на полевую проблему. Этот принцип был успешно использован для снятия торговых запретов с Италии во время вспышки ВПГ 2000 года.
- Люди безусловно могут быть инфицированы вирусами птичьего, свиного и других зоонозных гриппов, такими как подтипы вируса птичьего гриппа H5N1, H7N9 и H9N2 и подтипы вируса свиного гриппа H1N1, H1N2 и H3N2. Однако эпидемиологически наиболее значимыми исторически являются 2 подтипа вируса свиного гриппа А: H1N1 и H3N2, и вирус гриппа типа В
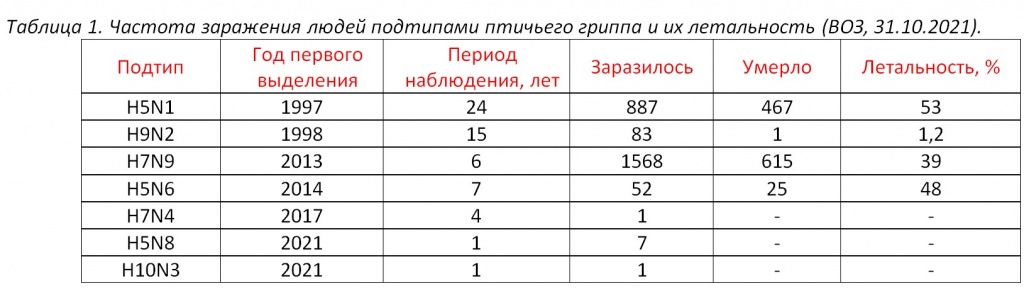
Доказано, что реассортация вирусов гриппа происходит в организме свиней, а значит при выполнении первого пункта, более тщательному мониторингу и контролю необходимо подвергать именно свиноводческие предприятия. Статистические данные случаев заражения человека штаммами птичьего гриппа не идут ни в какое сравнение с масштабами даже сезонных эпидемий (Табл. 1).
Большинство случаев инфицирования людей вирусом гриппа H5N1 и H7N9 были связаны с прямым или косвенным контактом с инфицированными живыми или мертвыми птицами. Контроль заболевания в животном источнике имеет решающее значение для снижения риска для людей.
Заражение людей вирусами птичьего гриппа происходит чаще в Азиатских странах в результате контакта человека с больной птицей или контаминированной средой, как правило на рынках живой птицы.
Показатель летальности ВПГ H5N1, H7N9 и H5N6 безусловно высок в странах с низким уровнем санитарии и качества медицинского обслуживания (Египет, Индонезия, Вьетнам, Камбоджа), однако заболеваемость не сопоставима со статистикой обычного сезонного гриппа (340 млн – 1 млрд человек в год). Фактов передачи возбудителя птичьего гриппа между людьми выявлено не было, и вероятность появления у него такой способности пока крайне низкая.
Первые случаи заражения людей вирусом H9N2 произошли на материковой части Китая в 1998 г., затем в Гонконге в 1999 г. Основной контингент – дети в возрасте до 8 лет. Позже вирус был выделен от людей в Египте, Бангладеш, Пакистане и Омане.
Выделение H9N2 от человека чаще происходит в периоды, когда исследуются другие, более патогенные вирусы зоонозного гриппа, например H7N9 в Китае и H5N1 в Египте. Инфицирование человека H9N2, как правило, протекает в легкой форме. К концу 2021 года число случаев заболевания людей выросло до 83, причем более половины из них были зарегистрированы с 2015 года, включая 1 летальный исход на фоне общего низкого статуса здоровья пациента.
В большинстве случаев в качестве вероятного источника инфицирования был подтвержден контакт с домашней птицей и, в отличие от H7N9, до сих пор нет подтвержденных сообщений о передаче вирусов H9N2 от человека человеку. Секвенирование вирусов показывает, что все человеческие изоляты H9N2 содержат гены HA из линий G1-W, G1-E или BJ94 с вирусными изолятами, тесно связанными с местными изолятами домашней птицы.
3. В ситуации панзоотии при фактах официального применения вакцин против ВПГ/НПГ странами-импортерами необходимо обсуждать вопросы неправомерности выставления ими требований о недопущении вакцинации при производстве птицеводческой продукции на территории РФ. Это вопрос переговоров.
Пути решения проблемы
Сложившаяся ситуация не безвыходная: положительный опыт борьбы с возбудителем гриппа птиц накоплен в ряде стран.
На фоне большого числа споров и спекуляций по поводу целесообразности вакцинации птиц промышленного стада можно с уверенностью сказать, что такая мера не только не противоречит принципам защиты отрасли и населения от угрозы вспышки пандемии птичьего гриппа, но и доказала свою высокую эффективность на практике. Существенным преимуществом использования вакцинации является контроль распространения вируса путем значительного снижения его выделения инфицированным поголовьем в окружающую среду.
Из-за экономического ущерба, причиняемого энзоотией H9N2, многие страны, включая Китай, Израиль, Южную Корею, Марокко, Пакистан, Египет, Иран и ОАЭ, приняли вакцинацию на национальном или местном уровне в качестве ключевого подхода к профилактике болезни H9N2 у домашней птицы. Наиболее распространены традиционные инактивированные вакцины. Вирусы H9N2 демонстрируют широкую антигенную изменчивость, как между линиями, так и внутри них. В отличие от человеческих вакцин, вакцины против H9N2, как правило, не так регулярно оцениваются на эффективность против антигенно дрейфующих вирусов и, следовательно, обновляются гораздо реже. Поэтому, во многих регионах вирусы H9N2 продолжают вызывать заболевание у вакцинированной птицы доказывая, что неоптимальное использование вакцинации может привести к антигенному дрейфу, а также к теоретическому зоонозному потенциалу и патогенности. В связи с этим существует реальная необходимость: лучшего понимания молекулярных детерминант антигенности H9, антигенного дрейфа и последствий для зоонозного потенциала вируса и вакцин следующего поколения, защищающих от нескольких штаммов и антигенно дрейфующих вариантов.
Искоренение через выбраковку потенциально инфицированных птиц - это первая линия защиты от H9N2 в странах, с короткой историей присутствия вируса. Так было во время ранних вспышек в Корее и и Гане, в Росси – в начале ситуации. Однако, как только вирус становится эндемичным в стране, искоренение становится неэкономичным и неосуществимым, поэтому вакцинация обычно используется после этого момента. Искоренение чаще используется во время вспышек ВПГ из-за статуса болезни, подлежащей уведомлению, независимо от страны с историей вспышек и эндемичности.
Опыт множества стран, где поголовье полностью вакцинируется от НПГ (а в ряде регионов и от ВГП), показывает, что такой подход дает возможность избавиться от заболевания птицы и людей и улучшает общую статистику.
В качестве примера можно привести опыт Израиля. Начиная с 2002 года, решением проблемы там стала продуманная схема вакцинации, успех которой был связан с хорошими техническими возможностями как в идентификации циркулирующих штаммов, так и в выборе правильных генотипов для производства вакцин. Так, к 2019 году в Израиле было разработано около десятка вакцин против НПГ H9N2. Причины такого разнообразия понятны - эффективность любой вакцины от гриппа снижается в течение двух-трех лет из-за частых мутаций полевых вирусов путем антигенного дрейфа (точечных мутаций в генах кодирующих Н и N).
Не менее успешный опыт борьбы с ВПГ/НПГ в Азии показал эффективность комплексной программы биозащиты, неотъемлемой частью которой является тотальная вакцинация птицепоголовья.
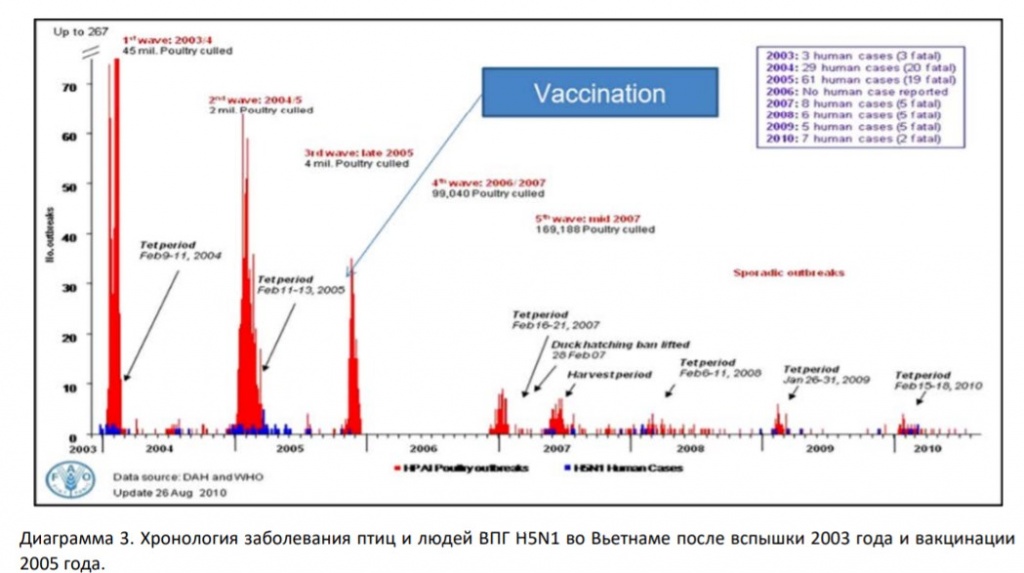
Панзоотию 1997 года в Гонконге (H5N1), после первого случая заражения человека в 2003 году, также удалось погасить лишь путем поголовной вакцинации всей птицы, поступающей на рынки. Хронология вспышек H5N1 во Вьетнаме 2003–2010 гг. еще раз подтвердила высокую эффективность вакцинации, начатой в 2005 году, в том числе для профилактики заболевания людей (диаграмма 3).
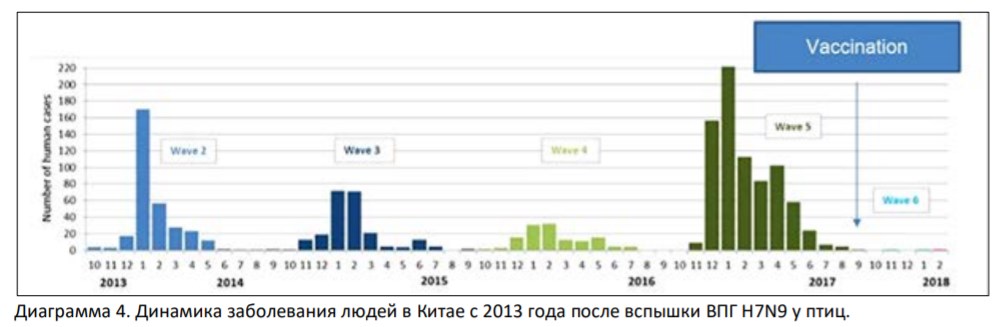
Появившийся в Китае в 2013 году изначально НПГ H7N9 мутировал в форму ВПГ и в начале 2017 года вызвал тяжелые вспышки заболеваний у домашней птицы, а также пять волн инфицирования людей, угрожая дальнейшим распространением. В сентябре 2017 года была введена двухвалентная инактивированная вакцина H5/H7 для кур, после которой частота выделения вируса H7N9 у домашней птицы снизилась на 93,3%. Что еще более важно, в период с 1 октября 2017 г. по 30 сентября 2018 г. было зарегистрировано только три случая заболевания людей H7N9, что свидетельствует о высочайшей эффективности вакцинация домашней птицы в профилактике H7N9 у людей. Эти факты подчеркивают, что активный контроль болезней животных чрезвычайно важен для борьбы с зоонозами и защиты здоровья человека (Диаграмма 4, 5).

В США вакцинация против ВПГ Н5 успешно использовалась в качестве дополнительного инструмента контроля при вспышках: 1995 г. в штате Юта, 2000 г. в штате Калифорния и 2002 г. в штате Колорадо. На пятьдесят второй Западной конференции по болезням домашней птицы, состоявшейся в Сакраменто, штат Калифорния, в марте 2003 года, была предложена схема, в соответствии с которой вакцинация включалась в стратегию борьбы при определенных сценариях эпизоотий.
И по сей день интенсивная профилактика НПГ Н9N2 с помощью вакцинации проводится во многих странах Ближнего Востока, Азии и Западной Африки: Израиль, Ю. Корея, Марокко, Пакистан, Египет, Иран, ОАЭ. Лидером в профилактике НПГ является Китай, где было изготовлено более 10 вариантов коммерческих вакцин подтипа Н9N2.
Руководство Республики Казахстан, опираясь на мировой опыт решения проблемы, в 2015 году также приняло решение о вакцинации всех видов промышленной птицы против НПГ H9N2.
При оценке эффективности вакцинопрофилактики ВПГ/НПГ следует обратиться также и к опыту ряда европейских стран: в период 2000–2011 гг. птицу с разной интенсивностью вакцинировали в Италии, Португалии, Франции и Нидерландах, что в короткие сроки привело к стабилизации ситуации.
Кроме применения коммерческих вакцин в мировой практике широко используют «кастомные» аутогенные вакцины, изготовленные из штаммов возбудителей, выделенных на индивидуальных птицефабриках. В настоящий момент производство и использование данных вакцин в Российской Федерации законодательно не урегулировано, однако появление такой возможности в ближайшем будущем помогло бы решить целый ряд хронических проблем птицеводческой отрасли, одновременно снизив количество антибиотиков и вероятность развития МАР.
С учетом непростой ситуации в отрасли и мире и отсутствием препятствий распространению вирусов гриппа, российские птицеводы будут вынуждены прибегнуть к тем же мерам, какие использовали в прошлом и снова планируют применить наши зарубежные коллеги. Так, например, Министерство сельского хозяйства Франции вновь рассматривает профилактическую вакцинацию домашней птицы как неотъемлемую часть более целенаправленной борьбы с почти ежегодно происходящими крупными вспышками ВПГ в стране.
Необходимые корректировки в новые Правила по борьбе с ВПГ/НПГ
- Необходимо доработать новые «Правила по борьбе с гриппом птиц» в отношении методов утилизации павших и вынужденно умерщвленных птиц и полученной от них продукции в эпизоотическом очаге. Новые ограничения в виде сжигания не позволяют, в случае возникновения вспышки на больших предприятиях, завершить процесс изъятия и утилизации в отпущенные правилами сроки в 7 календарных дней со дня принятия решения об организации и проведении отчуждения птиц. Для этого в перечне допустимых методов утилизации биоматериала необходимо снова предусмотреть возможность его захоронения в пределах территории площадки, а также рассмотреть и одобрить метод компостирования внутри помещений, не противоречащий Правилам по борьбе с гриппом птиц, а именно - проведение утилизации в условиях, исключающих рассеивание предполагаемого возбудителя болезни во внешней среде (для объектов, где имеется живая птица).
- Рассмотреть возможность отмены принудительной вакцинации птицы угрожаемой зоны в ЛПХ, проводить ПЦР и серомониторинг ее в качестве индикатор циркуляции полевых штаммов на территории, прилегающей к промышленным птицеводческим объектам.
Биозащита, как фактор обеспечения биологической безопасности птицеводческих предприятий.
В благополучные годы в отрасли, ссылаясь на большие расстояния и низкую концентрацию птицефабрик, были убеждены, что грипп не грозит российскому птицеводству, и поэтому уделяли недостаточно внимания вопросам повышения биологической защищенности производственных объектов как при планировании строительства новых площадок, так и при их эксплуатации. При этом постоянно сохранялся высокий риск заноса новых возбудителей с импортом генетического материала из-за рубежа, а также сезонных вспышек эпизоотий вдоль маршрутов миграции перелетных птиц.
Грамотная система биозащиты – краеугольный камень безопасности предприятия и его устойчивого развития! Качественный лабораторный мониторинг незаменимы на этапе раннего выявления проблем, выстраивания и корректировки схемы вакцинопрофилактики, оценки ее эффективности, а также дифференциальной диагностики причин патологии.
Превентивные и перспективные меры по снижению риска заноса и распространения ВПГ/НПГ
- Установить контакт со специалистами министерства природных ресурсов и экологии, охотпользователями для получения результатов обследования охотугодий на предмет выявления заболевших, павших диких птиц. Усилить эпиднадзор за дикими и синантропными птицами с целью оценки вирусного фона и потенциала заноса новых подтипов ВПГ/НПГ в регионах с высокой концентрацией птицеводческих объектов. При проведении мониторинга следовать «Методическим рекомендациям по организации мониторинга заносов и распространения гриппа птиц в природных условиях на территории Российской Федерации»
- Проводить более интенсивную работу с охотниками и населением по информированию о рисках заражения и правилам профилактики гриппа птиц.
- Организовать учет и серомониторинг поголовья свиней и лошадей в прилегающих к птицеводческим объектам населенных пунктах.
- Запретить продажу живой птицы на рынках, выставках и культурных мероприятиях, охоты с птицами-приманками.
- Утвердить круглогодичное содержание птицы в закрытых помещениях с целью предотвращения прямых и косвенных контактов между дикой и домашней птицей.
- Применить систему раннего обнаружения потенциального присутствия вирусов в птицеводческих хозяйствах на основе мониторинга изменений в производственных показателях.
- Усилить программу мониторинга частного сектора и прицефабрик за птичьим гриппом, направленную на выявление низкопатогенных вирусов гриппа.
- Усилить общие санитарные мероприятия на предприятии, включая схему подготовки и дезинфекции в санитарно-профилактический перерыв.
- Рассмотреть возможность сокращений количества обслуживающего персонала без ущерба для исполнения технологии, изучить пути максимальной автоматизации производства.
- Применить профилактическую вакцинацию в районах высокого риска (места с большим количеством перелетных диких птиц в непосредственной близости от птицефабрик или вдоль миграционных путей).
- Минимизировать респираторные стрессы от применения усиленных схем вакцинации против респираторных и иммуносупрессорных вирусов.
- Сократить количество живых вакцинаций с переносом их в инкубаторий.
- Начать профилактику НПГ на родительских стадах и курах-несушках посредством 2–3-кратной вакцинации в период выращивания и однократно во время продуктивного цикла в возрасте 40–50 недель;
- Начать вакцинацию бройлеров в суточном возрасте, если общие мероприятия по недопущения распространению болезни оказались неэффективны.
- Начать вакцинацию индейки 2–3-кратно в зависимости от наличия и уровня материнских и поствакцинальных антител с учетом рекомендаций производителя вакцины.
- Организовать регулярный серомониторинг материнского и поствакцинального иммунитета в реакции РТГА со специфическим антигеном.
- Организовать обязательный ПЦР мониторинг всех партий птицы предубойного возраста с целью недопущения контаминации убойного завода.
- Ужесточить правила в отношении норм строительства: увеличение санитарных зон как минимум вдвое от существующих согласно СанПиН 2.2.1/2.1.1.1200-03.
- Котноролировать соблюдение правил выбора участков для строительства новых площадок: географическая изолированность, удаленность от водоемов, населенных пунктов, транспортных магистралей, других животноводческих объектов, с учетом розы ветров.
- Ограничить размер новых объектов для гарантированного соблюдения принципа «полно-пусто».
- Организовать санразрывы и период покоя площадок, обеспечивающих естественное «обеззараживание» помещений от большинства патогенов: при напольном содержании всех видов взрослой птицы и ремонтного молодняка - 4 недели; при клеточном содержании взрослой птицы и ремонтного молодняка - 3 недели; при напольном (на подстилке, сетчатых полах) и клеточном выращивании на мясо молодняка всех видов птицы - 2 недели и один дополнительный перерыв в году после последнего цикла - не менее 2 недель;
- Планировать строительство новых объектов с учетом требований новых Правил по гриппу птиц по зонам карантинирования при вспышках гриппа (угрожаемая зона 10 км вместо 5 км).
- Не допускать к эксплуатации новые объекты, несоответ
Сопровождения предприятий свиноводства и птицеводства
Мы используем ветеринарные препараты нового поколения
На вашу птицефабрику или свиноводческий комплекс
Все товары и услуги сертифицированы


